题目内容
氮及其化合物对国民经济和社会发展具有重要的意义.
(1)已知:12.8g液态N2H4与足量H2O2反应生成N2和气态H2O,放出256.65kJ的热量.①H2O(l)=H2O(g)△H=+44kJ?mol-1
②2H2O2(l)=2H2O(l)+O2(g)△H=-196.4kJ?mol-1则液态N2H4与足量O2反应生成N2和液态H2O的热化学方程式为 .
(2)意大利科学家用电化学方法直接使氮气与水发生反应生成了氨气,反应的化学方程式为:
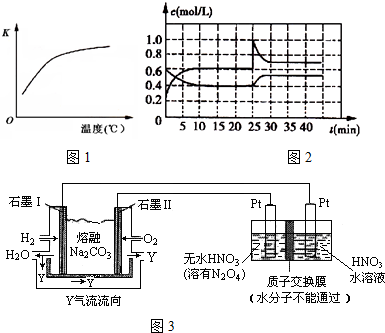
2N2(g)+6H2O(g)?4NH3(g)+3O2(g)△H=QkJ?mol-1.当该反应转移1.2mol电子时,生成标准状况下NH3的体积为 L.该可逆反应的平衡常数K与温度的关系如图1所示,由此可判断Q 0(填“>”、“=”或“<”)
(3)一定温度下,在一容积为2L的密闭容器中,通入一定量NO2和N2O4的混合气体,测得这两种物质的浓度随时间的变化关系如图2所示.0~10min内N2O4的平均反应速率v(N2O4)= ,在第25min时,改变的反应条件是 ,第35min时,反应N2O4?2NO2的化学平衡常数K= .若在第25min时加入0.2mol NO2和0.4mol N2O4,则反应的v(N2O4)正 v(NO2)逆(填“>”、“=”或“<”).
(4)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.现以H2、O2、熔融Na2CO3组成的燃料电池为电池,采用电解法制备N2O5,装置如图3所示,其中Y为CO2
①写出石墨Ⅰ电极上的电极方程式 .
②燃料电池中每消耗1mol氢气,理论上最多可制得N2O5 g.
③电解反应完成后,取出少量阴极区的溶液,滴加氨水至溶液呈中性,下列说法错误的是 (填字母).
a.电解前后阴极区HNO3水溶液的pH基本保持不变
b.滴加氨水后的中性溶液中存在:c(NO3-)>c(NH4+)
c.滴加氨水后的中性溶液中存在:c(NH4+)+c(NH3?H2O)=c(NO3-)
d.常温下浓硝酸与浓氨水反应产生白烟,这是因为两者发生了氧化还原反应.

(1)已知:12.8g液态N2H4与足量H2O2反应生成N2和气态H2O,放出256.65kJ的热量.①H2O(l)=H2O(g)△H=+44kJ?mol-1
②2H2O2(l)=2H2O(l)+O2(g)△H=-196.4kJ?mol-1则液态N2H4与足量O2反应生成N2和液态H2O的热化学方程式为
(2)意大利科学家用电化学方法直接使氮气与水发生反应生成了氨气,反应的化学方程式为:
2N2(g)+6H2O(g)?4NH3(g)+3O2(g)△H=QkJ?mol-1.当该反应转移1.2mol电子时,生成标准状况下NH3的体积为
(3)一定温度下,在一容积为2L的密闭容器中,通入一定量NO2和N2O4的混合气体,测得这两种物质的浓度随时间的变化关系如图2所示.0~10min内N2O4的平均反应速率v(N2O4)=
(4)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.现以H2、O2、熔融Na2CO3组成的燃料电池为电池,采用电解法制备N2O5,装置如图3所示,其中Y为CO2
①写出石墨Ⅰ电极上的电极方程式
②燃料电池中每消耗1mol氢气,理论上最多可制得N2O5
③电解反应完成后,取出少量阴极区的溶液,滴加氨水至溶液呈中性,下列说法错误的是
a.电解前后阴极区HNO3水溶液的pH基本保持不变
b.滴加氨水后的中性溶液中存在:c(NO3-)>c(NH4+)
c.滴加氨水后的中性溶液中存在:c(NH4+)+c(NH3?H2O)=c(NO3-)
d.常温下浓硝酸与浓氨水反应产生白烟,这是因为两者发生了氧化还原反应.
考点:热化学方程式,常见化学电源的种类及其工作原理,化学平衡常数的含义,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)根据盖斯定律来计算化学反应的焓变;
(2)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,根据转移电子和方程式系数之间的关系来计算,对于放热反应,温度越高,K越小,对于吸热反应,温度越高,K越大.
(3)根据v=
计算v(NO2),根据影响化学反应速率的因素和化学平衡移动的因素来回答判断改变的条件,根据Qc和K的关系确定化学反应的移动方向;
(4)①燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水;
②燃料原电池中,负极上燃料失电子发生氧化反应,根据电极反应结合电子守恒计算即可;
③根据溶液显示中性时,氢离子和氢氧根离子浓度相等以及电荷守恒等知识来回答判断.
(2)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,根据转移电子和方程式系数之间的关系来计算,对于放热反应,温度越高,K越小,对于吸热反应,温度越高,K越大.
(3)根据v=
| △c |
| △t |
(4)①燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水;
②燃料原电池中,负极上燃料失电子发生氧化反应,根据电极反应结合电子守恒计算即可;
③根据溶液显示中性时,氢离子和氢氧根离子浓度相等以及电荷守恒等知识来回答判断.
解答:
解:(1)12.8g液态N2H4与足量H2O2反应生成N2和气态H2O,放出256.65kJ的热量,即③N2H4(l)+2 H2O2(l)=N2(g)+4H2O(g)△H=-641.625kJ/mol
①H2O(l)=H2O(g)△H=+44kJ?mol-1
②2H2O2(l)=2H2O(l)+O2(g)△H=-196.4kJ?mol-1,液态N2H4与足量O2反应生成N2和液态H2O的热化学方程式为N2H4(l)+O2(g)=N2(g)+2H2O(l)
③-②-①×4=-641.625kJ/mol+196.4kJ?mol-1-(+44kJ?mol-1)×4=-621.225 kJ?mol-1,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-621.225 kJ?mol-1;
(2)反应2N2(g)+6H2O(g)?4NH3(g)+3O2(g)△H=QkJ?mol-1中,化合价升高值=化合价降低值=转移电子数=12,即生成4mol氨气,转移电子是12mol,
当该反应转移1.2mol电子时,生成氨气的物质的量是0.4mol,标准状况下NH3的体积为0.4mol×22.4L/mol=8.96L,该可逆反应的平衡常数K随着温度的升高而增大,所以改反应是吸热反应,即焓变大于零,故答案为:8.96;>;
(3)根据物质的量浓度的变化之比等于系数之比知道,0~10min内N2O4的平均反应速率v(N2O4)=
=
=0.02mol/(L?min),在第25min时,二氧化氮和四氧化二氮的浓度都增加,但是二氧化氮的浓度是瞬间增大,即改变的反应条件是增大了NO2的浓度,第35min时,反应N2O4?2NO2的化学平衡常数K=
=0.9mol/L,在第25min时加入0.2mol NO2和0.4mol N2O4,则反应的Qc<K,所以平衡正向进行,即v(N2O4)正>v(NO2)逆,
故答案为:0.02 mol?(L?min)-1;增大了NO2的浓度;0.9;>;
(4)①燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为H2+CO32--2e-=CO2+H2O,故答案为:H2+CO32--2e-=CO2+H2O;
②N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价,因此应该在左侧生成N2O5,即在阳极区域生成,据电极反应离子放电顺序可知:阳极为N2O4+2HNO3-2e-=2N2O5+2H+,结合①中的反应,燃料电池中每消耗1mol氢气,理论上最多可制得2molN2O5,质量是216g,故答案为:216;
③a.阴极区是无水的硝酸,是氢离子得电子产生氢气的过程,该区域硝酸以分子存在,所以HNO3水溶液的pH基本保持不变,故a正确;
b.滴加氨水后的中性,根据电荷守恒,溶液中存在:c(NO3-)=c(NH4+),故B错误;
c.滴加氨水后的中性溶液中存在:c(NH4+)+c(NH3?H2O)=2c(NO3-),故c错误;
d.常温下浓硝酸与浓氨水反应产生白烟,这是因为两者发生了反应生成硝酸铵的缘故,该反应不是氧化还原反应,没有化合价变化,故d错误.
故选bcd.
①H2O(l)=H2O(g)△H=+44kJ?mol-1
②2H2O2(l)=2H2O(l)+O2(g)△H=-196.4kJ?mol-1,液态N2H4与足量O2反应生成N2和液态H2O的热化学方程式为N2H4(l)+O2(g)=N2(g)+2H2O(l)
③-②-①×4=-641.625kJ/mol+196.4kJ?mol-1-(+44kJ?mol-1)×4=-621.225 kJ?mol-1,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-621.225 kJ?mol-1;
(2)反应2N2(g)+6H2O(g)?4NH3(g)+3O2(g)△H=QkJ?mol-1中,化合价升高值=化合价降低值=转移电子数=12,即生成4mol氨气,转移电子是12mol,
当该反应转移1.2mol电子时,生成氨气的物质的量是0.4mol,标准状况下NH3的体积为0.4mol×22.4L/mol=8.96L,该可逆反应的平衡常数K随着温度的升高而增大,所以改反应是吸热反应,即焓变大于零,故答案为:8.96;>;
(3)根据物质的量浓度的变化之比等于系数之比知道,0~10min内N2O4的平均反应速率v(N2O4)=
| △c |
| △t |
| 0.2mol/L |
| 10min |
| c2(NO2) |
| c(N2O4) |
故答案为:0.02 mol?(L?min)-1;增大了NO2的浓度;0.9;>;
(4)①燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为H2+CO32--2e-=CO2+H2O,故答案为:H2+CO32--2e-=CO2+H2O;
②N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价,因此应该在左侧生成N2O5,即在阳极区域生成,据电极反应离子放电顺序可知:阳极为N2O4+2HNO3-2e-=2N2O5+2H+,结合①中的反应,燃料电池中每消耗1mol氢气,理论上最多可制得2molN2O5,质量是216g,故答案为:216;
③a.阴极区是无水的硝酸,是氢离子得电子产生氢气的过程,该区域硝酸以分子存在,所以HNO3水溶液的pH基本保持不变,故a正确;
b.滴加氨水后的中性,根据电荷守恒,溶液中存在:c(NO3-)=c(NH4+),故B错误;
c.滴加氨水后的中性溶液中存在:c(NH4+)+c(NH3?H2O)=2c(NO3-),故c错误;
d.常温下浓硝酸与浓氨水反应产生白烟,这是因为两者发生了反应生成硝酸铵的缘故,该反应不是氧化还原反应,没有化合价变化,故d错误.
故选bcd.
点评:本题目综合考查学生热化学和电化学、化学反应速率和平衡的综合知识,考查学生综合知识的能力,难度大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
X、Y、Z、W、R属于短周期主族元素.X的原子半径短周期主族元素中最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述错误的是( )
| A、X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 |
| B、Y的氢化物比R的氢化物稳定,熔沸点高 |
| C、Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z |
| D、RY2、WY2通入BaCl2溶液中均有白色沉淀生成 |
甲烷的分子式为CH4,下列四位同学在讨论CH4的意义,其中错误的是( )
A、 |
B、 |
C、 |
D、 |
用惰性电极进行电解,下列说法正确的是( )
| A、电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 |
| B、电解稀氢氧化钠溶液,要消耗OH-,故溶液PH减小 |
| C、电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2 |
| D、电解稀硫酸溶液,实质上是电解水,故溶液PH不变 |
 选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: 钢铁是21世纪用途最广的结构材料和功能材料.其成分主要是Fe和少量C.
钢铁是21世纪用途最广的结构材料和功能材料.其成分主要是Fe和少量C.