题目内容
【题目】采用电化学法还原CO2是一种使CO2资源化的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( ) 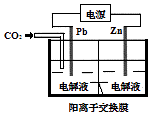
A.Pb与电源的正极相连
B.ZnC2O4在离子交换膜右侧生成
C.正极反应式为:Zn﹣2e﹣═Zn2+
D.标准状况下,当11.2 L CO2参与反应时,转移0.5mol电子
【答案】D
【解析】解:A、采用电化学法还原CO2制备ZnC2O4的过程中,碳元素的化合价降低,所以通入二氧化碳的电极是阴极,即Pb是阴极,和电源的负极相连,故A错误; B、在阴极上,二氧化碳得电子得C2O42﹣,在阳极上,金属锌失电子成为锌离子,从阳极移向阴极,所以ZnC2O4在交换膜左侧生成,故B错误;
C、Zn是阳极不是正极,金属锌失电子成为锌离子,反应式为:Zn﹣2e﹣═Zn2+ , 故C错误;
D、电解的总反应为:2C02+Zn ![]() ZnC2O4 , 2mol二氧化碳反应伴随2mol电子转移,当通入标况下的11.2 L CO2时,转移0.5 mol电子,故D正确.
ZnC2O4 , 2mol二氧化碳反应伴随2mol电子转移,当通入标况下的11.2 L CO2时,转移0.5 mol电子,故D正确.
故选D

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


