题目内容
硅单质及其化合物应用范围很广.请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅.三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
石英砂
粗硅
SiHCl3粗
SiHCl3纯
高纯硅
(1)试推测:
①由纯SiHCl3制备高纯硅的化学方程式 .
②整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学方程式 ;H2还原SiHCl3过程中若混入O2,可能引起的后果是
(2)下列有关硅材料的说法正确的是
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料--光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅.
(1)制备硅半导体材料必须先得到高纯硅.三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
石英砂
| 焦炭 |
| 高温 |
| HCl |
| 573K以上 |
| 精馏 |
| H2 |
| 1357K |
(1)试推测:
①由纯SiHCl3制备高纯硅的化学方程式
②整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学方程式
(2)下列有关硅材料的说法正确的是
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料--光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅.
考点:硅和二氧化硅
专题:碳族元素
分析:(1)①氢气和纯SiHCl3反应生成高纯硅;
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气,氢气易爆炸;
(2)A.原子晶体熔点高,耐高温;
B.原子晶体熔点高硬度大;
C.二氧化硅具有折光性;
D.盐熔点较高;
E.硅与盐酸不反应.
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气,氢气易爆炸;
(2)A.原子晶体熔点高,耐高温;
B.原子晶体熔点高硬度大;
C.二氧化硅具有折光性;
D.盐熔点较高;
E.硅与盐酸不反应.
解答:
解:(1)①氢气和纯SiHCl3反应生成高纯硅和氯化氢:SiHCl3+H2
Si+3HCl,故答案为:SiHCl3+H2
Si+3HCl;
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:SiHCl3+3H2O═H2SiO3+H2↑+3HCl,氢气遇氧气易爆炸,
故答案为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl;高温下,H2遇O2发生爆炸;
(2)A.SiC和Si3N4均为原子晶体,熔点高,性质稳定,故A正确;
B.SiC和Si3N4均为原子晶体,硬度大,熔点高,性质稳定,故B正确;
C.二氧化硅具有折光性,可用于光导纤维,故C正确,
D.普通玻璃的主要成分为Na2SiO3和CaSiO3,它是以石英砂(SiO2)、石灰石(CaCO3)和纯碱(Na2CO3)为主要原料反应制成的,熔点很高,故D正确;
E.常温下,Si只能与唯一一种酸HF反应,不与HCl反应,故E错误.
故答案为:ABCD.
| ||
| ||
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:SiHCl3+3H2O═H2SiO3+H2↑+3HCl,氢气遇氧气易爆炸,
故答案为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl;高温下,H2遇O2发生爆炸;
(2)A.SiC和Si3N4均为原子晶体,熔点高,性质稳定,故A正确;
B.SiC和Si3N4均为原子晶体,硬度大,熔点高,性质稳定,故B正确;
C.二氧化硅具有折光性,可用于光导纤维,故C正确,
D.普通玻璃的主要成分为Na2SiO3和CaSiO3,它是以石英砂(SiO2)、石灰石(CaCO3)和纯碱(Na2CO3)为主要原料反应制成的,熔点很高,故D正确;
E.常温下,Si只能与唯一一种酸HF反应,不与HCl反应,故E错误.
故答案为:ABCD.
点评:本题综合考查硅和二氧化硅的性质,为高频考点,侧重于化学与工业生产的考查,题目难度中等,注意相关基础知识的积累.

练习册系列答案
相关题目
实验室用下列两种方法制氯气:①用含HCl 4mol的浓盐酸与足量的MnO2反应;②用1mol MnO2与足量浓盐酸反应.所得的氯气( )
| A、①比②多 | B、②比①多 |
| C、一样多 | D、无法比较 |
下列各组物质的关系中,其中属于同分异构体的是( )
| A、O2 和O3 |
| B、16O 和18O |
| C、正丁烷和异丁烷 |
| D、甲烷和乙烷 |
设N为阿伏加德罗常数的数值,下列说法正确的是( )
| A、100mL lmol/LFeCl3溶液中含有Fe3+为0.1NA |
| B、80g CuO和Cu2S的混合物含有铜原子数一定为0.1NA |
| C、0.1mol冰醋酸和0.1mol乙醇在加热和浓硫酸条件下充分反应生成的水分子数为0.1NA |
| D、2.24 L CH3CH3含有的分子数为0.1NA |
能区分胶体和溶液的实验方法是( )
| A、静置,有沉淀现象的是胶体 |
| B、有丁达尔现象的是胶体 |
| C、不能透过滤纸的是胶体 |
| D、用肉眼观察,均一、透明的是溶液 |
下列实验方法不正确的是( )
| A、用澄清石灰水鉴别Na2CO3和NaHCO3溶液 |
| B、用焰色反应鉴别NaCl和KCl |
| C、用丁达尔效应鉴别硫酸钠溶液和硅酸胶体 |
| D、用BaCl2溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 |
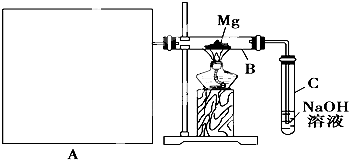 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性.
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性.