题目内容
实验室临时用NaOH溶液和CO2来制取纯Na2CO3溶液.已知CO2气体在通入NaOH溶液过程中极易过量而生成NaHCO3,且无现象.
实验室有下列试剂:①未知浓度的NaOH溶液;②37%盐酸;③37%硫酸;④14%盐酸;⑤大理石;⑥K2CO3固体;⑦Cu2(OH)2CO3.
实验室有下列仪器:铁架台;启普发生器;量筒;烧杯;橡皮管;玻璃导管;分液漏斗.
已知各物质在常温下的溶解度如下表:
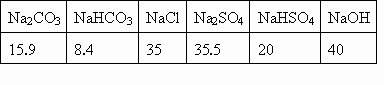
(1)本实验应选用的仪器,除启普发生器;橡皮管;玻璃导管外,还需要________.
(2)为保证制得的Na2CO3溶液尽量纯,应选用的药品,除①外,还需要________.
(3)简要叙述实验步骤,直至得纯Na2CO3溶液(仪器安装可省略)
(4)根据给出的溶液度表,求出当NaOH溶液中溶质的质量分数大于多少时,在配制过程中会有晶体析出(写出计算步骤和必要的文字说明)?
解析:
|
(1)量筒、烧杯 (2) ④⑤ (3)①由量筒量取溶液至洁净烧杯中 ②用启普发生器、14%盐酸、碳酸钙制取CO2通入①中烧杯至过量 ③用量筒量取VmLNaOH溶液与②中烧杯溶液混合 (4)由表中可知配制过程中的沉淀为NaHCO3 为了控制二氧化碳通入的量,防止过量的二氧化碳生成碳酸氢钠,应用量筒量取反应物,使生成的二氧化碳适量. 二氧化碳与氢氧化钠的反应用烧杯作反应容器. 为了防止浓盐酸中氯化氢挥发,应用稀盐酸. 为了防止反应过快,应用块状碳酸钙即大理石而不用碳酸钾粉未. (4)由表中可知配制过程中的沉淀为NaHCO3. 设该NaHCO3溶液中有100g水,则m(NaHCO3)>8.4g] 由NaOH+CO2=NaHCO3 40 84 4.0g 8.4g 则m(NaOH)>4.0g 故w(NaOH)> |
提示:
|
用氢氧化钠与二氧化碳反应来制取碳酸钠应注意参加反应的二氧化碳的量,及反应的速率. |

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案实验室现有如下仪器:铁架台,试管,量筒,烧杯,胶头滴管,单孔橡皮塞,玻璃导管,分液漏斗。
下表所列为有关物质在常温时的溶解度(g/100 g水):
Na2CO3 | NaHCO3 | NaCl | Na2SO4 | NaHSO4 | NaOH |
15.9 | 8.40 | 35.8 | 35.5 | 20.0 | 40.0 |
(1)本实验应选用的仪器,除试管、胶头滴管、单孔橡皮管、玻璃导管外,还应有_____________。
(2)为了制取Na2CO3溶液,应选用合理的药品,除①外,还需要:___________________。
(3)为了制得只含Na2CO3溶质的溶液,请你设计一个实验方案(仪器安装不必叙述)_______________________________________________________________________________。
(4)根据给出的溶解度数据和上述实验方案,若保证在配制过程中不析出晶体,所用NaOH溶液中含NaOH溶质的质量分数的最大值是________________________________________。
④14%的盐酸 ⑤大理石 ⑥K2CO3固体 ?⑦Cu2(OH)2CO3??
实验室有下列仪器:铁架台、启普发生器、烧杯(100 mL)、橡皮管、玻璃导管、分液漏斗、试剂瓶(200 mL)、碱式滴定管(50 mL)、烧瓶(250 mL)。?
下表列出各物质在常温时的溶解度(g/100 g H2O):
Na2CO3 | NaHCO3 | NaCl | Na2SO4 | NaHSO4 | NaOH |
15.9 | 8.4 | 35 | 35.5 | 20 | 40 |
(1)本实验应选用的仪器:除启普发生器、橡皮管、玻璃导管外,还需要 。?
(2)为保证制得的Na2CO3溶液尽量纯,应选用的药品有? 。??
(3)简述必要的实验步骤,直到制得较纯的Na2CO3溶液(仪器安装省略)。?
(4)根据给出的溶解度表,求出当NaOH溶液中溶质的质量分数大于多少时,在配制过程中会有晶体析出(列出简要的计算步骤和必要的文字说明)???????????????
实验室临时需要用NaOH溶液和CO2来制取Na2CO3溶液。已知CO2气体在通入NaOH溶液时极易因其过量而生成NaHCO3,且无明显现象。实验室可供选择的试剂有:①未知浓度的NaOH溶液 ②37%盐酸 ③40%硫酸 ④14%盐酸 ⑤大理石 ⑥K2CO3固体 ?⑦Cu2(OH)2CO3粉末
实验室现有如下仪器:铁架台,试管,量筒,烧杯,胶头滴管,单孔橡皮塞,玻璃导管,分液漏斗。
下表所列为有关物质在常温时的溶解度(g/100 g水):
| Na2CO3 | NaHCO3 | NaCl | Na2SO4 | NaHSO4 | NaOH |
| 15.9 | 8.40 | 35.8 | 35.5 | 20.0 | 40.0 |
(1)本实验应选用的仪器,除试管、胶头滴管、单孔橡皮管、玻璃导管外,还应有_____________。
(2)为了制取Na2CO3溶液,应选用合理的药品,除①外,还需要:___________________。
(3)为了制得只含Na2CO3溶质的溶液,请你设计一个实验方案(仪器安装不必叙述)_______________________________________________________________________________。
(4)根据给出的溶解度数据和上述实验方案,若保证在配制过程中不析出晶体,所用NaOH溶液中含NaOH溶质的质量分数的最大值是________________________________________。