题目内容
【题目】一定条件下在一容积恒为2L的容器内发生反应:2A(g)+B(g)![]() 2C(g),已知起始投入4molA(g)和2molB(g),经2s后测得C的浓度为0.6mol/L,并且2s后各组分浓度不再改变。下列说正确的是( )
2C(g),已知起始投入4molA(g)和2molB(g),经2s后测得C的浓度为0.6mol/L,并且2s后各组分浓度不再改变。下列说正确的是( )
A.2s内用物质A表示的平均反应速率为0.6mol/(L·s)
B.该条件下,该反应的平衡常数为K=![]()
C.2s后每有0.6mol的物质B生成,同时就有0.6mol物质C生成
D.2s时物质B的浓度为0.7mol/L
【答案】D
【解析】
A. 2s内用物质C表示的平均反应速率为v(C)= ![]() =
= ![]() =0.3mol/(Ls),v(A)=v(C)=0.3mol/(Ls),故A错误;
=0.3mol/(Ls),v(A)=v(C)=0.3mol/(Ls),故A错误;
B. 2A(g)+B(g) ![]() 2C(g)
2C(g)
起始(mol)4 2 0
转化(mol)2x x 2x
平衡(mol)4-2x 2-x 2x
由题意2x=0.6,x=0.3mol/L,K=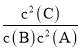 =
=![]() ,故B错误;
,故B错误;
C. 0.6mol的物质B生成,表示逆反应方向,同时有0.6mol物质C生成,表示正反应方向,正逆反应速率之比为1:1,不等于系数之比2:1,未处于平衡状态,反应向正反应方向进行,故C错误;
D. △c(B)=![]() △c(C)=
△c(C)=![]() ×0.6mol/L=0.3mol/L,2s时物质B的浓度为
×0.6mol/L=0.3mol/L,2s时物质B的浓度为![]() -0.3mol/L=0.7mol/L,故D正确。
-0.3mol/L=0.7mol/L,故D正确。
正确答案是D。

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目