题目内容
9.下列各原子或离子的基态电子排列式错误的是( )| A. | N3-:1s22s22p3 | B. | F-:1s22s22p6 | ||
| C. | Fe2+:1s22s22p63s23p63d6 | D. | O2-:1s22s22p6 |
分析 根据微粒中存在的电子数,再根据构造原理书写核外电子排布式,简单阳离子中核外电子数=质子数-电荷数,简单阴离子中核外电子数=质子数+电荷数.
解答 解:A.N原子核外有7个电子,N3-的核外有10个电子,核外电子排布式为1s22s22p6,故A错误;
B.F原子核外有9个电子,F-的核外有10个电子,核外电子排布式为1s22s22p6,故B正确;
C.Fe原子核外有26个电子,Fe2+的核外有24个电子,核外电子排布式为1s22s22p63s23p63d6,故C正确;
D.O原子核外有8个电子,O2-的核外有10个电子,核外电子排布式为1s22s22p6,故D正确;
故选A.
点评 本题考查的是构造原理及各能级最多容纳的电子数,题目难度不大,注意把握原子核外电子排布规律.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
17.工业上消除氮氧化物的污染可用如下反应:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的恒容密闭容器中,测得n(N2)随时间变化的数据如表.下列说法不正确的是( )
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(N2) | 0 | 0.20 | 0.35 | 0.40 | 0.40 |
| T2 | n(N2) | 0 | 0.25 | … | 0.30 | 0.30 |
| A. | T1温度下,CH4的平衡转化率为50% | |
| B. | T1<T2 | |
| C. | a<0 | |
| D. | T2时反应的平衡常数大于T1时反应的平衡常数 |
4.一定温度下,10mL0.4mol/LH2O2溶液发生催化分解.不同时刻测得生成O2的体积(已折算为标准状况)如下表:下列叙述不正确的是(溶液体积变化忽略不计)( )
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6~10的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反应至6min时,c(H2O2)=0.20mol/L | |
| D. | 反应至6min时,H2O2分解了40% |
1.用 NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molCl2与足量 Fe 反应,转移的电子数为 3NA | |
| B. | 在常温常压下,1.7g NH3含有的原子数为 0.4NA | |
| C. | 标准状况下,11.2 L 水中含有的原子数是 1.5NA | |
| D. | 0.2 mol?L-1 的 Na2SO4溶液中含 Na+数目为 0.4NA |
18.如图图示对应的实验操作均正确的是( )
| A. |  | B. |  | C. | 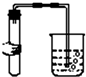 | D. |  |
19.下列说法正确的是( )
| A. | 常温下pH=4的溶液中,Na+、SiO32-、SO42-、K+可以大量共存 | |
| B. | 对滴有酚酞的碳酸钠溶液微热,溶液颜色加深 | |
| C. | 乙醇和乙酸都能溶于水,都是电解质 | |
| D. | 室温下,某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |

 .
.

