题目内容
17.“N原子2P轨道上有3个未成对电子”,支撑这一结论的理论是( )| A. | 构造原理 | B. | 泡利原理 | C. | 洪特规则 | D. | 能量最低原理 |
分析 构造原理决定了原子、分子和离子中电子在各能级的排布;
泡利原理原理是说每个轨道(例如1s轨道,2p轨道中的px)最多只能容纳两个自旋相反的电子;
洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同;
能量最低原理是核外电子排布时,尽先占据能量最低的轨道.
解答 解:N原子2P轨道上有3个未成对电子,支撑这一结论的理论是洪特规则,即在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同;
故选C.
点评 本题主要考查了核外电子排布的规律,难度不大,注意对规律的理解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.既可以用来鉴别甲烷和乙烯,又可以用来除去乙烷中混有的乙烯,得到纯净乙烷的方法( )
| A. | 与足量酸性高锰酸钾反应 | B. | 依次通入通入足量溴水和浓硫酸中 | ||
| C. | 在一定条件下通入H2 | D. | 分别进行燃烧 |
12.下列说法中错误的是( )
| A. | 同系物的化学性质相似 | |
| B. | 同系物的分子组成相差一个或几个CH2原子团 | |
| C. | 若烃中碳、氢元素的质量分数相同,它们必定是同系物 | |
| D. | 互为同分异构体的两种有机物的物理性质有差别,但化学性质可能相似 |
2.下列各组物质中,化学键类型不同的是( )
| A. | NaCl和HNO3 | B. | H2O和NH3 | C. | CaF2和MgCl2 | D. | CCl4和HCl |
6.下列电子式错误的是( )
| A. |  | B. |  | C. | 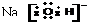 | D. |  |
7.各取0.1mol Cu分别投入足量的下列四种酸溶液中(必要时可以加热):①浓硫酸②浓硝酸③稀硝酸④稀硫酸,充分反应后得到的气体体积(相同条件下)由大到小的顺序是( )
| A. | ①②③④ | B. | ②①③④ | C. | ②④①③ | D. | ③④①② |
 过碳酸钠(2Na2CO3•3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,易分解.可用纯碱与H2O2反应制取,反应方程式为:2Na2CO3(aq)+3H2O2(aq)?2Na2CO3•3H2O2(s)△H<0,如图是制取过碳酸钠 的示意图,步骤如下
过碳酸钠(2Na2CO3•3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,易分解.可用纯碱与H2O2反应制取,反应方程式为:2Na2CO3(aq)+3H2O2(aq)?2Na2CO3•3H2O2(s)△H<0,如图是制取过碳酸钠 的示意图,步骤如下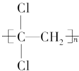 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由CCl2=CH2(写结构简式)发生加聚反应生成的.
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由CCl2=CH2(写结构简式)发生加聚反应生成的.