题目内容
在一体积为10 L的容器中,通过一定量的CO和H2O,850 ℃时发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)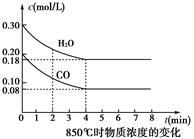
(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=______mol·L-1·min-1。
(2)如图中4~5min之间该反应________(填“是”或“否”)处于平衡状态,判断理由________________________________________________________________________。
(1)0.03 (2)是 反应物的浓度不再变化
解析试题分析:(1)根据图像可知,0~4 min内CO浓度减少了0.20mol/L-0.08mol/L=0.12mol/L,平均反应速率v(CO)=0.12mol/L÷4min=0.03 mol·L-1·min-1。
(2)根据图像可知,反应进行到4min时各种物质的浓度不再发生变化,反应达到平衡状态,则4~5min之间该反应是处于平衡状态。
考点:考查反应速率的计算和平衡状态的判断
点评:该题是基础性试题的考查,难度不大。明确反应速率的计算依据和平衡状态的特征是解题的关键,有利于培养学生的逻辑思维能力和规范答题能力。

合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式 。
②由上表数据可知该反应为放热反应,理由是 。
③理论上,为了增大平衡时H2的转化率,可采取的措施是 。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g)
 CO(g)+3H2(g) 获取,已知该反应中,当初始混合气
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
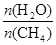 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: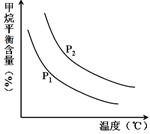
①图中,两条曲线表示压强的关系是:P1 P2(填“>”、“=”或“<”)。
②该反应为 反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g)+H2O(g)
 CO2 (g)+H2(g) 获取。
CO2 (g)+H2(g) 获取。①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度
为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说
明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2)=1 : 16 : 6 : 6
一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)  Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
| 反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
| c(X)/(mol·L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
(1)3min时用Z表示的平均反应速率v(Z)= 。
(2)分析该反应中反应物的浓度与时间的规律,得出的结论是 。由此规律推出反应在6min时反应物的浓度a为 mol·L-1。
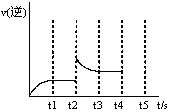
(3)反应的逆反应速率随时间变化的关系如图,t2时改变了某一种条件,改变的条件可能是 、 (填写两顶)
(4)下列哪些情况表明容器中已达平衡状态 (填字母序号)
A.容器体积一定时气体密度不再变化
B.反应的平衡常数不再变化
C.容器中气体的平均相对分子质量不随时间而变化
D.Y的物质的量不再发生变化
E.Z的生成速率等于X的消耗速率的2倍
(16分)高铁酸钠(Na2FeO4)具有很强的氧化性,广泛应用于净水、电池工业等领域。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下,回答下列问题: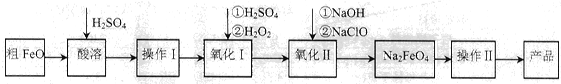
已知:NaClO不稳定,受热易分解。
(1)粗FeO酸溶过程中通入水蒸气(高温),其目的是__________________________。
(2)操作I目的是得到高纯度FeSO4溶液,则氧化I中反应的离子方程式为_________。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备
①Cl2与NaOH溶液反应的离子方程式为_________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/℃ | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
其原因为____________________________________________________________________。
(4)工业也常用电解法制备Na2FeO4,其原理为Fe+2OH-+2H2O电解FeO42-+3H2↑。请用下列材料设计电解池并在答题卡的方框内画出该装置。

可选材料:铁片、铜片、碳棒、浓NaOH溶液、浓HCl等
其阳极反应式为:________________________________。
 放出气泡很慢,加入少量MnO
放出气泡很慢,加入少量MnO 很快产生气体:________;
很快产生气体:________; 3C(g),2分钟达到平衡,生成1.5 mol
3C(g),2分钟达到平衡,生成1.5 mol  zC达到平衡:
zC达到平衡: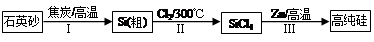
 Si(S)+2ZnCl2(l) △H1<0
Si(S)+2ZnCl2(l) △H1<0