题目内容
17.融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通入CO,另一极通入空气与CO2的混合气,制得在650℃下工作的燃料电池,完成有关的电池反应式:正极反应式:O2+2CO2+4e-═2CO32-;
总反应的化学方程式:2CO+O2═2CO2.
分析 燃料电池中,正极上氧气得电子和二氧化碳反应生成碳酸根离子,在得失电子相同条件下将正负极电极反应式相加即可得电池反应式,据此分析解答.
解答 解:该熔融盐燃料电池中,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-═2CO32-,又负极电极反应式为2CO+2CO32--4e-═4CO2,在得失电子相同条件下将正负极电极反应式相加得电池反应式2CO+O2═2CO2,
故答案为:O2+2CO2+4e-═2CO32-;2CO+O2═2CO2.
点评 本题考查化学电源新型电池,侧重考查电极反应式的书写,燃料电池电极反应式的书写是学习难点,燃料电池中,负极上燃料失电子、正极上氧化剂得电子,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.某有机物的结构为 ,它不可能具有的性质是( )
,它不可能具有的性质是( )
①易溶于水;②可以燃烧;③能使酸性高锰酸钾溶液褪色;④能跟氢氧化钾溶液反应;
⑤能跟碳酸氢钠溶液反应;⑥能发生聚合反应.
 ,它不可能具有的性质是( )
,它不可能具有的性质是( )①易溶于水;②可以燃烧;③能使酸性高锰酸钾溶液褪色;④能跟氢氧化钾溶液反应;
⑤能跟碳酸氢钠溶液反应;⑥能发生聚合反应.
| A. | ①④ | B. | ①②⑥ | C. | ①⑤ | D. | ③⑤⑥ |
8.下列各表述与示意图一致的是( )
| A. |  表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. |  图中曲线表示反应2SO2 (g)+O2 (g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. |  表示10 mL 0.01 mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2 C2 O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 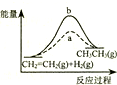 图中a、b曲线分别表示反应CH2=CH2 (g)+H2 (g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
12.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 双氧水催化分解 | B. | 乙醇燃烧 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 氯化铵与氢氧化钡晶体反应 |
2.下列离子方程式中,错误的是( )
| A. | 将氧化亚铁通入盐酸中:FeO+2H+═Fe2++H2O | |
| B. | 将少量的铜屑放入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag | |
| C. | 在澄清的石灰水中通入过量SO2:SO2+OH-═HSO3- | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3+CO32-+2H2O |
9.某K2CO3样品可能含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将13.8g样品加入足量水,样品全部溶解,再加入过量CaCl2溶液,得到9g沉淀.以下对样品所含杂质的判断正确的是( )
| A. | 肯定有KNO3 | B. | 肯定没有Ba(NO3)2,可能含有KNO3 | ||
| C. | 肯定没有Ba(NO3)2和Na2CO3 | D. | 肯定有KNO3,可能还含有Na2CO3 |
6.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 石油、沼气、天然气、植物油都属于可再生能源 | |
| B. | 水蒸气变为液态水时放出的能量就是该变化的反应热 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
 和
和 ⑧
⑧ 和
和 ⑨
⑨ 和
和