题目内容
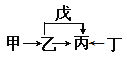
【题目】下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料. 
(1)写出A在加热条件下与H2反应的化学方程式
(2)写出E与A的氢化物反应生成A的化学方程式
(3)写出一个由D生成B的化学方程式;
(4)将5mL0.10molL﹣1的E溶液与10mL0.10molL﹣1的NaOH溶液混合. ①写出反应的离子方程式;
②反应后溶液的pH7(填“大于”、“小于”或“等于”),理由是;
③加热反应后的溶液,其pH(填“增大”、“不变”或“减小”),理由是 .
【答案】
(1)H2+S ![]() H2S
H2S
(2)H2SO3+2H2S═3S↓+3H2O
(3)C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)
CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O等
CuSO4+SO2↑+2H2O等
(4)H2SO3+2OH﹣═SO32﹣+2H2O;大于;Na2SO3溶液中SO32﹣发生水解使溶液显碱性;增大;升高温度促进Na2SO3溶液的水解
【解析】解:固态单质A能与空气中的氧气反应生成气体物质B,则A可能为C或S等,假定为S,则B为SO2 , C为SO3 , 它们的相对分子质量为64:80=4:5,恰好与题意相符(同时也证明A不是C),则D为H2SO4 , 它是一种重要的工业原料,与题意也相符,进一步证明A为S,E为H2SO3 , (1)A为S,可与氢气反应生成硫化氢,反应的方程式为H2+S ![]() H2S,所以答案是:H2+S
H2S,所以答案是:H2+S ![]() H2S;(2)H2SO3与H2S反应生成S,反应的方程式为H2SO3+2H2S═3S↓+3H2O,所以答案是:H2SO3+2H2S═3S↓+3H2O;(3)浓硫酸可与C、Cu等还原性物质在加热的条件下反应生成SO2 , 反应的方程式可为C+2H2SO4(浓)
H2S;(2)H2SO3与H2S反应生成S,反应的方程式为H2SO3+2H2S═3S↓+3H2O,所以答案是:H2SO3+2H2S═3S↓+3H2O;(3)浓硫酸可与C、Cu等还原性物质在加热的条件下反应生成SO2 , 反应的方程式可为C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)
CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O等,所以答案是:C+2H2SO4(浓)
CuSO4+SO2↑+2H2O等,所以答案是:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)
CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O等;(4)①将5mL 0.10molL﹣1的H2SO3溶液与10mL 0.10molL﹣1的NaOH溶液混合,二者恰好反应,反应的离子方程式为H2SO3+2OH﹣═SO32﹣+2H2O,所以答案是:H2SO3+2OH﹣═SO32﹣+2H2O;②反应生成Na2SO3 , 为强碱弱酸盐,水解呈碱性,溶液pH>7,所以答案是:大于;Na2SO3溶液中SO32﹣发生水解使溶液显碱性;③水解反应为吸热过程,升高温度促进水解,所以答案是:增大;升高温度促进Na2SO3溶液的水解.
CuSO4+SO2↑+2H2O等;(4)①将5mL 0.10molL﹣1的H2SO3溶液与10mL 0.10molL﹣1的NaOH溶液混合,二者恰好反应,反应的离子方程式为H2SO3+2OH﹣═SO32﹣+2H2O,所以答案是:H2SO3+2OH﹣═SO32﹣+2H2O;②反应生成Na2SO3 , 为强碱弱酸盐,水解呈碱性,溶液pH>7,所以答案是:大于;Na2SO3溶液中SO32﹣发生水解使溶液显碱性;③水解反应为吸热过程,升高温度促进水解,所以答案是:增大;升高温度促进Na2SO3溶液的水解.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
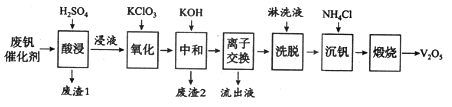
回答下列问题:
(1)五氧化二钒是一种催化剂,可将SO2转化为SO3,请写出该反应的化学方程式____________。
(2)“酸浸”时V2O5转化为VO2+,反应的离子方程式为_________________________,同时V2O4转成VO2+。“废渣1”的主要成分是_____________。
(3)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(4)“中和”作用之一是使钒以V4O124—形式存在于溶液中。“废渣2”中含有_______。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。