��Ŀ����
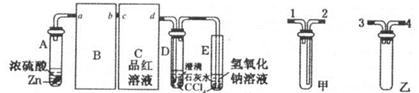
���ü�������������ȡ����Ӧ��ȡ����Ʒ����������ڹ�ҵ���ѳ�Ϊ��ʵ��ij��ѧ��ȤС��ͨ����ʵ������ģ���������̣�����Ƶ�ģ��װ�����£�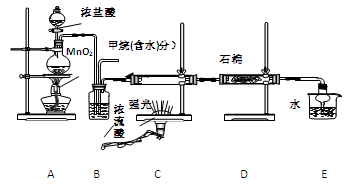
��1�� Bװ�������ֹ��ܣ��ٿ��������ٶȣ��ھ��Ȼ�����壻��
|
��4�� ��Cװ���У�����һ��ʱ���ǿ�����䣬����Ӳ�ʲ������ڱ��к�ɫС����������д���û�����ɫС�����Ļ�ѧ����ʽ ��
��5�� Eװ���г������⣬�������л����E�з�����������ѷ���Ϊ ��
A.��Һ�� B.���� C.��ȡ��Һ�� D.�ᾧ��
��6����װ�û���ȱ�ݣ�ԭ����û�н���β����������β����Ҫ�ɷ�Ϊ �����ţ�
A��CH4 B��CH3Cl C��CH2Cl2 D��CHCl3
(12��) ��ÿ��2�֣���1�������������� ��2��4 ��3�� ��ȥδ��Ӧ��������
��4��CH4+2Cl2C+4HCl ��5��A ��6��A ��B
���������������1��Ũ���������ˮ�ԣ������ɵ������к���ˮ������Bװ�ó����п��������ٶȡ����Ȼ������֮�⣬�����и������á�
��2����������鷢��ȡ����Ӧ����Ӧ�ص���1mol������ȡ��1molHԭ������1molHCl�������V(Cl2)/V(CH4)��x���������������������Ȼ��⣬��xֵӦ��֤���鱻��ȫȡ������x��4��
��3���������������ԣ�KI�У�1�۵ĵ��ܱ���������������Ϊ�Ȼ��ع���͵ⵥ�ʣ����ԣ�Dװ�õ�ʯ���о��Ȼ���KI��ĩ�����������չ�����������
��4��������������Ӧ����һ�ȼ���ķ���ʽΪ CH4+2Cl2C+4HCl��
��5��Eװ���г��������������⣬�����ж��ȼ��顢���ȼ�������Ȼ�̼�����ȼ��顢���ȼ�������Ȼ�̼������ˮ�����÷�Һ�ֿ�����ѡA��
��6����Ӧ���ɵĶ��ȼ��顢���ȼ��顢���Ȼ�̼������״��Һ�壬ֻ��һ�ȼ��������壬��������й����ļ��飬��β������Ҫ�ɷ���һ�ȼ���ͼ��飬��ѡAB��
���㣺�����������Ʊ��������ͼ��鷢��ȡ����Ӧ���й��жϡ����ʵķ�����ᴿ��
�����������ǻ���������Ŀ��飬�ѶȲ�����ȷ����Ļ�ѧ�����Ǵ���Ĺؼ�������������Ҫ���Գ���������ѡ�á�ʵ���������Ϊ���ģ�ͨ����ʲô��Ϊʲô���������ص㿼��ʵ����������Ĺ淶�Ժ�ȷ���������֪ʶ���ʵ�������������

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�ij��ѧС�����Na2SO3������ʵ��̽����
��1���ڰ�ɫ��ΰ��a��b��c���������е���Na2SO3��Һ���ٷֱ�μ���ͼ��ʾ���Լ���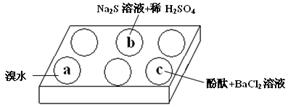
ʵ���������±���
| ��� | ʵ������ |
| a | ��ˮ��ɫ |
| b | ��������ɫ���� |
| c | �����̪��Һ��죬�ټ���BaCl2��Һ����������Һ�ɫ��ȥ |
����ʵ��������з�����
�� a��ʵ������֤��Na2SO3���� �ԡ�
�� b�з�����Ӧ�����ӷ���ʽ�� ��
�� Ӧ�û�ѧƽ��ԭ������c�������û�ѧ���P�����ֱ����� ��
��2������NaOH ��Һ����SO2�Ĺ����У������õ�Na2SO3��NaHSO3�Ļ����Һ����ҺpH ��n(SO32-):n(HSO3-) �仯��ϵ���±���
| n(SO32��)�� n(HSO3��) | 91��9 | 1��1 | 9��91 |
| pH | 8.2 | 7.2 | 6.2 |
�� ������Һ��n(SO32-):n(HSO3-) ="10:1" ʱ����Һ������Ũ�ȹ�ϵ��ȷ���� ������ĸ����
A��c(Na+) +c(H+) = 2c(SO32-) +c(HSO3-) + c(OH-)
B��c(Na+) > c(HSO3-) > c(SO32-) > c(OH-)>c(H+)
C��c(Na+) > c(SO32-) > c(HSO3-) > c(OH-)>c(H+)
����n(SO32-):n(HSO3-) = 3:2����0.8 mol NaOH��Һ�����˱�״���µ�SO2 L��
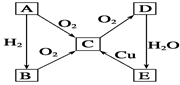
��ѧ��ѧ�������ʼס��ҡ�������֮�����ת����ϵ���ף��ҨD��������������˵����ȷ���ǣ� ��
| A������Ϊͭ����Ϊ�Ȼ�����������һ�����Ȼ��� |
| B������Ϊ̼����Ϊ�裬���һ���Ƕ�����̼ |
| C������Ϊ������Ϊ��������һ���������� |
| D������Ϊþ����Ϊ����������һ������ |
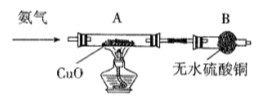


 Fe2O3 + 2Al
Fe2O3 + 2Al