题目内容
20.下列有关化学用语的表示正确的是( )| A. | NH4Cl的电子式: | |
| B. | Cl-的结构示意图: | |
| C. | 二氧化碳的电子式:${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$C${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ | |
| D. | 中子数为16的硫离子:${\;}_{16}^{32}$S2- |
分析 A.氯化铵中氯离子为阴离子,氯离子的电子式中需要标出最外层电子;
B.氯离子的核电荷数为17,不是18;
C.二氧化碳分子中存在两个碳氧双键,不存在C-O单键;
D.质量数=中子数+质子数,元素符号的左上角为质量数、左下角为质子数.
解答 解:A.氯化铵是离子化合物,由氨根离子与氯离子构成,其正确的电子式为: ,故A错误;
,故A错误;
B.氯离子的核电荷数为17,核外电子总数为18,氯离子的离子结构示意图为: ,故B错误;
,故B错误;
C.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故C错误;
,故C错误;
D.中子数为16的硫离子的质量数为32,该原子可以表示为:${\;}_{16}^{32}$S2-,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、元素符号等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
10.在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H=-92.3KJ/mol 0~4min时,容器内气体压强为101KPa,反应过程中,SO2、O2、SO3的物质的量n (mol)的变化如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(S{O}_{2})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$.
(2)在3min-4min及7min-9min时间段,反应处于平衡状态.
(3)计算:0~3min时间内,用SO2表示该反应的平均反应速率是0.08mol/min,7min时,SO2的转化率为30%.
(4)第5min时,从速率和转化率两个方面分析,改变的外界条件是增大压强;平衡向正反应方向移动.
(5)在101Kpa、500℃时,O2的物质的量与SO2平衡时的体积百分含量的变化曲线如图1:
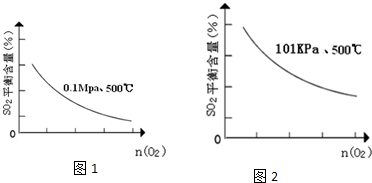
在图中2画出在相同压强下,温度为400℃时,起始O2的物质的量与SO2平衡时的体积百分含量的大致变化曲线.
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
(1)该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(S{O}_{2})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$.
(2)在3min-4min及7min-9min时间段,反应处于平衡状态.
(3)计算:0~3min时间内,用SO2表示该反应的平均反应速率是0.08mol/min,7min时,SO2的转化率为30%.
(4)第5min时,从速率和转化率两个方面分析,改变的外界条件是增大压强;平衡向正反应方向移动.
(5)在101Kpa、500℃时,O2的物质的量与SO2平衡时的体积百分含量的变化曲线如图1:

在图中2画出在相同压强下,温度为400℃时,起始O2的物质的量与SO2平衡时的体积百分含量的大致变化曲线.
11.下列有关实验原理、操作或现象不正确的是( )
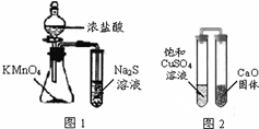

| A. | 下列有关实验原理、操作或现象不正确的是图1锥形瓶中滴入浓盐酸后充满黄绿色气体,试管中出现浅黄色浑浊 | |
| B. | 图2放置一段时间后,饱和CuSO4溶液中出现白色晶体 | |
| C. | 用玻璃棒蘸取某溶液做焰色反应实验,火焰呈黄色说明该溶液中不含钾元素 | |
| D. | 蒸馏时,将温度计水银球靠近蒸馏烧瓶支管口处 |
8.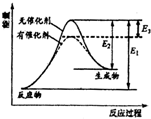 某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )
某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )
 某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )
某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )| A. | 该反应为放热反应 | B. | 该反应的焓变△H=E3 | ||
| C. | 催化剂不能降低反应的活化能 | D. | 该反应逆反应的焓变△H=E2-E1 |
12.下列物质属于碱性氧化物的是( )
| A. | SO3 | B. | CaO | C. | SO2 | D. | CO |
9.关于0.5molO2的下列说法正确的是( )
| A. | 体积为11.2L | B. | 摩尔质量是16g/mol | ||
| C. | 质量为32g | D. | 约含有6.02×1023个氧原子 |
10.阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )
| A. | 常温常压下,N2和O2混合气体22.4L所含的分子数少于6.02×1023 | |
| B. | 1L lmol.L-1 FeBr2溶液与l mol氯气反应时转移的电子数为3NA | |
| C. | 标准状况下,11.2L HF所含的分子数约为3.01×1023 | |
| D. | 0.5mol.L-1硫酸钠溶液中含有溶质离子总数为1.5NA |