题目内容
6.一定条件下,在一容积可变的密闭容器中,反应:2A(g)+B(g)$?_{△}^{催化剂}$2C(g)过程中的能量变化如图1所示.反应过程中,A、B、C的物质的量(mol)的变化如下表:| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| n(A) | 2.00 | 1.90 | 1.82 | 1.76 | 1.64 | 1.54 | 1.50 | 1.50 | 1.50 |
| n(B) | 1.00 | 0.95 | 0.91 | 0.88 | 0.82 | 0.77 | 0.75 | 0.75 | 0.75 |
| n(C) | 0 | 0.10 | 0.18 | 0.24 | 0.36 | 0.46 | 0.50 | 0.50 | 0.50 |

回答下列问题:
(1)反应的正反应△H<(填“大于”或“小于”)0.
(2)该反应达到平衡时,下列说法不正确的是D.
(A)气体的密度不再改变 (B)A的物质的量浓度不再改变
(C)放出或吸收的热量不再变化 (D)v正(A)=v逆(A)=0
(3)t°C时,在一容积为2L的恒容密闭容器内加入0.4molA和0.6molB,在一定条件下发生反应,反应中C的物质的量浓度变化情况如2图:该温度下,反应进行到1分钟时B物质的量为0.55mol.
分析 (1)依据图1可知反应物能量高于生成物,反应是放热反应;
(2)化学平衡状态是正逆反应速率相同,个组分含量保持不变,及其衍生的变量不变分析判断;
(3)根据三行式计算反应进行到1min时的各组分的物质的量.
解答 解:(1)图1可知反应物能量高于生成物,反应是放热反应,△H<0;
故答案为:<;
(2)2A(g)+B(g)=2C(g),反应是气体体积减小的放热反应;
A.反应前后气体质量不变,体积是可变的容器,气体密度不再改变,故A正确;
B.A的物质的量浓度不变是平衡标志,故B正确;
C.放出或吸收的热量不再变化,说明反应达到平衡状态,故C正确;
D.反应是可逆反应,达到平衡状态正逆反应速率相同但不为0,v正(A)=v逆(A)≠0,故D错误;
故答案为:D.
(3)①图象可知C的平衡浓度为0.1mol/L,
2A(g)+B(g)?2C(g)
起始量(mol) 0.4 0.6 0
变化量(mol) 0.1 0.05 0.1
末态量(mol) 0.3 0.55 0.1
反应进行到1分钟时B物质的量为0.55mol,故答案为:0.55mol.
点评 本题考查了化学平衡的影响因素分析,平衡常数和数据分析计算应用,主要是概念理解分析和图象的绘制,掌握基础是关键,题目难度中等.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
17.在元素周期表的第四周期的主族元素中,金属元素的种数是( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
14.下列有关物质的应用或性质的说法正确的是( )
| A. | 运用水玻璃堵塞管道,是因为水玻璃显碱性 | |
| B. | 配制碘水时,常加入少量的KI,目的是防止I2被还原 | |
| C. | 用酸化的高锰酸钾与H2O2可制取少量氧气,KMnO4作催化剂 | |
| D. | 明矾[KAl(SO4)2•12H2O]净水和液氯(Cl2)净水的原理不相同 |
11.苯甲酸广泛用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:

实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是紫色溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10-3mol,产品中苯甲酸质量分数的计算表达为$\frac{2.4×10{\;}^{-3}mol×4×122g/mol}{1.22g}$,计算结果为96%(保留二位有效数字).

实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是紫色溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解, 冷却、过滤 | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其熔化,测其熔点 | 熔点为122.4℃ | 白色晶体是苯甲酸 |
18.研究人员研制利用软锰矿浆(主要成分是MnO2)吸收流酸厂的尾气SO2,制备流酸锰的生产流程如下:
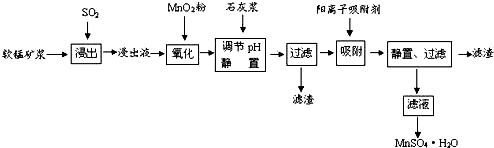
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+,等 其他金属离子,PbO2的氧化性大于MnO2,PbSO4是一种微溶物质.有关金属离子的半径、形成 氢氧化物沉淀时的pH见如表,阳离子吸附剂吸附金属离子的效果见如图.
请回答下列问题:
(1)写出浸出过程中生成反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节pH的范围为4.7≤pH<8.3.
(4)阳离子吸附剂可用于除去杂质金属离子•请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径、金属离子的电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6.现将c mol•L-1CaCl2溶液与2.00×10-2
mol•L-1Na2SO4溶液等体积混合 (忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-3mol•L-1.

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+,等 其他金属离子,PbO2的氧化性大于MnO2,PbSO4是一种微溶物质.有关金属离子的半径、形成 氢氧化物沉淀时的pH见如表,阳离子吸附剂吸附金属离子的效果见如图.

| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
(1)写出浸出过程中生成反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节pH的范围为4.7≤pH<8.3.
(4)阳离子吸附剂可用于除去杂质金属离子•请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径、金属离子的电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6.现将c mol•L-1CaCl2溶液与2.00×10-2
mol•L-1Na2SO4溶液等体积混合 (忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-3mol•L-1.
16.下列离方程式书写正确的是( )
| A. | 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| B. | NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+SO32-+2H2O | |
| C. | MnO2与浓盐酸制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| D. | AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4+ |

