题目内容
10.2L N2和CH4的混合气体与4L O2点燃充分反应后,用干燥剂除去水分,剩余气体的体积5L.原来气体中N2和CH4的物质的量之比(各气体体积都在相同的温度、压强下测定)为 ( )| A. | 1:3 | B. | 1:1 | C. | 2:1 | D. | 3:1 |
分析 甲烷反应的方程式为:CH4+2O2→CO2+2H2O,氮气与氧气不反应,根据反应前后的气体体积的变化用差量法计算出甲烷的体积,再计算出反应前混合气体中N2和CH4的物质的量之比.
解答 解:设原混合气体中含有xmlCH4,反应的方程式为CH4+2O2→CO2+2H2O,利用差量法计算:
CH4+2O2→CO2+2H2O△V
1 2 1 2
x 2x x 2x
则:2x=(2L+4L)-5L=1L,
解得:x=0.5L,
则所以混合气体中N2的体积为:2L-0.5L=1.5L,
相同条件下气体的体积之比等于物质的量之比,
则反应前混合气体中N2和CH4的物质的量之比为n(N2):n(CH4)=V(N2):V(CH4)=1.5L:0.5L=3:1.
故选D.
点评 本题考查混合气体的计算,题目难度不大,注意分析反应中的体积变化,溶解利用差量法进行计算,明确反应原理为解答本题的关键.

练习册系列答案
相关题目
20.下列有关化学用语的表示不正确的是( )
| A. | NaClO的电子式: | |
| B. | 16O的原子结构示意图: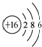 | |
| C. | 质子数为53,中子数为72的碘原子:53125I | |
| D. | 间羟基苯甲醛的结构简式: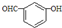 |
1.化学用语是学习化学的重要工具.以下化学用语或表述正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 碳正离子 中质子数与电子数之比值为3:2 中质子数与电子数之比值为3:2 | |
| C. | 水合氢离子的结构式为 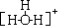 | |
| D. | NaHCO3水解反应的离子方程式:HCO3-+H2O?H3O++CO32- |
5.下列有机物其一氯代物的结构可能只有一种的是( )
| A. | C2H6 | B. | C3H8 | C. | C4H10 | D. | C5H12 |
15.能正确表示下列反应的离子方程式是( )
| A. | 铜加入稀硝酸中:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O | |
| B. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| C. | 向亚硫酸溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O | |
| D. | 大理石溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
20.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| B. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg | |
| C. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{△}^{蔗糖}$Ag |
 的同分异构体的结构简式:
的同分异构体的结构简式: .
.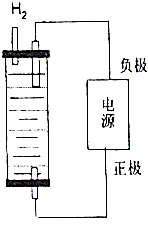 制取漂白粉的氯气通过电解饱和食盐水得到.
制取漂白粉的氯气通过电解饱和食盐水得到.

 .
. .
.