题目内容
为分析一种NaOH样品的纯度(其中杂质不与酸反应),用0.2mol×L-1盐酸标准液进行滴定,为了省去计算过程,可以使滴定所用的盐酸溶液的毫升数恰好等于NaOH样品的质量分数A%的A值,问:应称取多少克NaOH样品进行实验,才能满足上述要求?
解析:
解:根据NaOH和HCl发生中和反应中相应的物质的量关系,即n(NaOH)=n(HCl),n(HCl)等于盐酸的浓度乘以体积,而n(NaOH)等于NaOH样品的质量与质量分数的乘积除以摩尔质量,因此可列式找出样品的质量与盐酸体积、质量分数关系式而求解。 因为HCl~NaOH,设消耗盐酸为VmL,称取NaOH样品的质量为x, 0.2mol×L-1´V´10-3L=
依题意有V=A,所以x=0.8g 即应称取0.8gNaOH样品进行实验。
|

 巧学巧练系列答案
巧学巧练系列答案铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准。
(1)含铬废水排放到河水中一定浓度会使鱼类等水生动物死亡的原因是 ;
(2)铬元素以Cr2O72-的形式存在于酸性废水中,常用FeSO4将其还原为Cr3+,再用沉淀法进行分离。
|
|
① FeSO4还原Cr2O72-的离子方程式为 。
② Cr2 (SO4) 3溶液中加入过量NaOH浓溶液,反应的离子方程式为 。
③ 沉淀法分离废水中的Cr3+离子,pH应控制在 范围内。
④ 下列关于铬及其化合物的说法中正确的是 。
a.K2Cr2O7是一种常用的强氧化剂
b.NaCrO2溶液与AlCl3溶液混合有沉淀生成
c.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车
d.金属铬硬度大、耐腐蚀,是常用的镀层金属
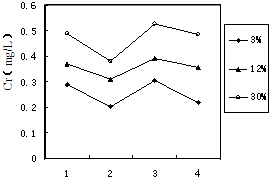
(3)铬冶炼工业的废渣粉碎后掺入煤矸石经过高温处理可以制砖,为了探究其中的铬元素在使用过程中是否会重新污染环境,研究组在一定条件下浸溶砖样,检测浸出液中Cr元素浓度,结果如图:


我国规定“固体废弃物浸出标准值含铬不得超过10 mg·L-1”。分析图表,可得出多个结论:
① 实验取用的砖样是否符合上述标准: 。
② 还能得出的其它结论是(写出2条即可): ; 。
 铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.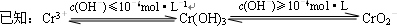 ①FeSO4还原Cr2O72-的离子方程式为
①FeSO4还原Cr2O72-的离子方程式为 铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准. ①FeSO4还原Cr2O72-的离子方程式为______.
①FeSO4还原Cr2O72-的离子方程式为______. ①FeSO4还原Cr2O72-的离子方程式为______.
①FeSO4还原Cr2O72-的离子方程式为______.