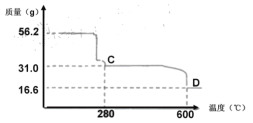
题目内容
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1molSO3(g)的ΔH=-99kJ·mol-1。请回答下列问题:

(1)图中A、C分别表示____,___,E的大小对该反应的反应热__(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点___(填“升高”或“降低”),ΔH___(填“变大”“变小”或“不变”)。
(2)图中ΔH=____kJ·mol-1。
(3)依据事实,写出下列反应的热化学方程式。
①1molN2(g)与适量H2(g)反应,生成NH3(g),放出92.2kJ热量:_____。
②1molCu(s)与适量O2(g)反应,生成CuO(s),放出157kJ热量:_____。
③在25℃、101kPa时,8 g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式是_____。
【答案】反应物总能量 生成物总能量 无 降低 不变 -198 N2(g)+3H2(g)=2NH3(g) ΔH=-92.2kJ·mol-1 2Cu(s)+O2(g)=2CuO(s) ΔH=-314kJ·mol-1 CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1
【解析】
(1)因图中A、C分别表示反应物总能量、生成物总能量;E为活化能,活化能的大小与反应热无关;加入催化剂改变了反应的途径,降低反应所需的活化能,所以E的变化是减小;因为催化剂可以降低反应的活化能,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热;
(2)因1molSO2(g)氧化为1molSO3的△H=-99 kJmol1,所以2molSO2(g)氧化为2molSO3的△H=-198kJmol1,则2SO2(g)+O2(g)=2SO3(g)△H=-198 kJmol1。
(3)①1molN2(g)与适量H2(g)反应,生成NH3(g),放出92.2kJ热量:N2(g)+3H2(g)=2NH3(g) ΔH=-92.2kJ·mol-1。
②1molCu(s)与适量O2(g)反应,生成CuO(s),放出157kJ热量,2molCu(s)与适量O2(g)反应,生成CuO(s),放出314kJ热量:2Cu(s)+O2(g)=2CuO(s) ΔH=-314kJ·mol-1。
③在25℃、101kPa时,8 g CH4为0.5mol,完全燃烧生成液态水时放出的热量是445.15kJ,1mol CH4完全燃烧生成液态水时放出的热量是890.3kJ,则CH4燃烧的热化学方程式是CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1。

【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数