题目内容
【题目】关于常温下pH=3的HF溶液,下列叙述正确的是
A. c(H+)=c(F-)
B. 加水稀释时,c(F-)/c(HF)增大
C. 与pH=11的NaOH溶液等体积混合后,溶液呈碱性
D. 加入NaF固体可以抑制HF的电离,使溶液中c(F-)减小
【答案】B
【解析】A、HF电离出的H+和F-浓度相等,水也电离出极少量的H+,所以c(H+)>c(F-),A错误;B、HF为弱酸,存在电离平衡,加水稀释时F-和HF的浓度均减小,但平衡正向移动,F-浓度的减小程度小于HF浓度的减小程度,所以c(F-)/c(HF)的比值增大,B正确;C、pH=3的HF与pH=11的NaOH等体积混合,因为HF为弱酸,所以HF过量,溶液呈酸性,C错误;D、HF![]() H++F-,加入NaF固体,F-浓度增大,平衡逆向移动,HF的电离程度减小,但F-的浓度仍然增大,D错误。正确答案为B。
H++F-,加入NaF固体,F-浓度增大,平衡逆向移动,HF的电离程度减小,但F-的浓度仍然增大,D错误。正确答案为B。

 名校课堂系列答案
名校课堂系列答案【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在室温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2% H2O2溶液 | 无 |
② | 10mL5% H2O2溶液 | 无 |
③ | 10mL5% H2O2溶液 | 1mL0.1mol/LlFeCl3溶液 |
④ | 10mL5% H2O2溶液+少量HCI溶液 | 1mL0.1mol/LlFeCl3溶液 |
⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol/LlFeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________。
(2)实验①和②的目的是_________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进________________________。
(3)写出实验③的化学反应方程式___________________________________。
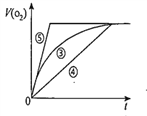
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析上图能够得出的实验结论是__________________________________________。
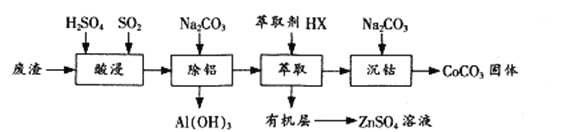
【题目】过渡金属催化的反应已成为重要的合成工具,贵金属成本高,会对环境造成的不利影响。因此研究成本低廉的含锰、铁、钴、镍、铜等催化剂应用成为热点。以下是以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
回答下列问题:
(1)“酸浸”时通入SO2的目的是 ____________,反应的离子方程式为______________。
(2)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 __________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 __________________。
(3)“沉钴”时Na2CO3溶液需缓慢滴加的原因是 ____________。
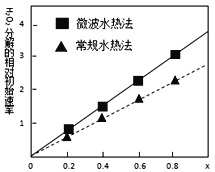
(4)用得到的CoCO3等为原料采用微波水热法和常规水热法可以制得两种CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价),均可用作H2O2分解的催化剂,有较高的活性。如图是两种不同方法制得的CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:____________法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是____________ 。
(5)用纯碱沉淀转化法也可以从草酸钴(CoC2O4)废料得到CoCO3,向含有CoC2O4固体的溶液中滴加Na2CO3溶液,当有CoCO3沉淀生成时,溶液中![]() =___________。[已知Ksp(CoC2O4)=6.3×10-8 Ksp (CoCO3)=1.4×10- 13]
=___________。[已知Ksp(CoC2O4)=6.3×10-8 Ksp (CoCO3)=1.4×10- 13]