题目内容
现有甲、乙、丙(如下图》三种晶体的晶胞:(甲中x处于晶胞的中心,乙中a处于
晶胞的中心),可推知:甲晶体中x与y的个数比是__________,乙中a与b的个数比是__________,丙晶胞中有_______个c离子,有____________个d离子。
4:3 1:1 4 4
【解析】
试题分析:根据均摊法可知,甲中的晶胞中含有1个原子,而y原子的个数是 个,则甲晶体中x与y的个数比是4:3;乙晶胞中a原子的个数是1个,b原子的个数是
个,则甲晶体中x与y的个数比是4:3;乙晶胞中a原子的个数是1个,b原子的个数是 个,则乙晶胞中a与b的个数比是1:1;丙晶胞中c离子的个数是
个,则乙晶胞中a与b的个数比是1:1;丙晶胞中c离子的个数是 个,d离子的个数是
个,d离子的个数是 个。
个。
考点:考查晶胞化学式的有关计算
点评:该题是高考中的常见题型和重要的考点,侧重对学生能力的培养。该题的关键是明确均摊法的原理,然后结合题意和晶胞结构直接列式计算即可,有利于培养学生的逻辑思维能力和规范答题能力。

物质 | 除杂方法(或试剂) | 化学方程式 |
CO(CO2) |
|
|
Na2CO3固体(NaHCO3) |
|
|
(2)某课外活动小组准备用如下图所示的装置进行实验。现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:

| A电极 | B电极 | X溶液 |
甲 | Cu | Zn | H2SO4 |
乙 | Pt | Pt | CuCl2 |
丙 | Fe | Cu | ? |
①甲同学在实验中将电键K5闭合,Zn电极上的电极反应式为___________________________。
②乙同学准备进行电解CuCl2溶液的实验,则电解时的总反应方程式为:__________________。
实验时应闭合的电键的组合是:____________________。(从下列五项中选择所有可能组合,第三小题也在这五项中选择)
A.K1和K2 B.K1和K
③丙同学准备在Fe上镀Cu,选择了某种盐来配制电镀液,则该盐中应含的阳离子的化学式为________,实验时,应闭合的电键的组合是________(选项如上)。
 某课外活动小组准备用如图所示的装置进行实验.现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:
某课外活动小组准备用如图所示的装置进行实验.现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液: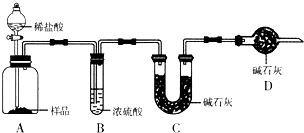 现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验.
现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验. 现有甲、乙、丙、丁4种物质,其中甲为单质,其余三种为化合物.转化关系如下:
现有甲、乙、丙、丁4种物质,其中甲为单质,其余三种为化合物.转化关系如下: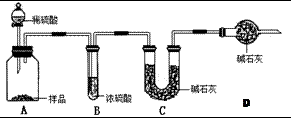 工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有:
工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有: