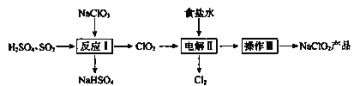
题目内容
【题目】氨气在工业上有广泛用途。请回答以下问题:
(1)工业上利用N2(g)+3H2(g) ![]() 2NH3(g) H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图。
2NH3(g) H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图。

①相对a而言,b可能改变的条件是____________,判断的理由是__________________;
②a条件下,0~t0的平均反应速率v(N2)=_____________mol·L-1·min-1;
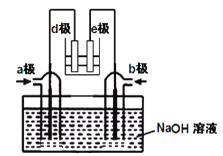
(2)有人利用NH3和NO2构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铝的精炼,如图B所示,e极为精铝。
a极通入____气体(填化学式),判断的理由是___________________________________;
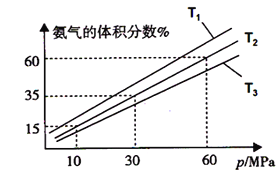
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,如图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在T2、60MPa下达到平衡。
①能判断N2(g)+3H2(g) ![]() 2NH3(g)达到平衡的是______(填序号) ;
2NH3(g)达到平衡的是______(填序号) ;
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②若T1、T2、T3温度下的平衡常数分别为K1、K2、K3,则K1、K2、K3由大到小的排序为_______________,
③此时N2的平衡分压为__________Mpa,(分压=总压×物质的量分数)
计算出此时的平衡常数Kp=________。(用平衡分压代替平衡浓度计算,结果保留2位有效数字并带上单位)
【答案】增大c(N2)a、b起始浓度相同,b到达平衡的时间缩短,且氢气的转化率增大(c0-c1)/300t0NO2e为精铝,发生还原反应,所以d极发生氧化反应,则a极为正极bdK1>K2>K390.043(Mpa)-2
【解析】
(1)①a、b氢气起始浓度相同,b到达平衡的时间缩短,说明反应速率增大,平衡时氢气的浓度减小,说明平衡正向移动,所以改变的条件是增大c(N2),故答案为:增大c(N2);a、b起始浓度相同,b到达平衡的时间缩短且氢气的转化率增大;
②a条件下,0~t0的平均反应速率v(N2)=![]() v(H2)=
v(H2)=![]() ×
×![]() =
=![]() ×
×![]() =
=![]() mol/(L·min),故答案为:
mol/(L·min),故答案为:![]() ;
;
(2)根据图知,e为精铝,为电解池阴极,d为阳极,所以通入a的电极是正极、通入b的电极是负极,原电池中NH3和NO2构成原电池,负极上失电子发生氧化反应,正极上得电子发生还原反应,原电池中二氧化氮得电子生成氮气,氨气失电子生成氮气,所以a电极上通入的是NO2,故答案为:NO2;e为精铝,发生还原反应,所以d极发生氧化反应,则a极为正极;
(3)①a.该反应是恒压,所以无论反应是否达到平衡状态压强都不变,所以不能据此判断平衡状态,故a错误;b.反应前后气体总质量不变但容器体积改变,所以混合气体的密度改变,当混合气体密度不变时该反应达到平衡状态,故b正确;c.3v正(N2)=v逆(H2)时该反应达到平衡状态,当v正(N2)=3v逆(H2)时该反应没有达到平衡状态,故c错误;d.反应前后混合气体质量不变,但气体总物质的量减小,所以混合气体相对分子质量增加,当混合气体的平均相对分子质量不再发生变化时,正逆反应速率相等,反应达到平衡状态,故d正确;故选bd;
②相同压强下,升高温度平衡逆向移动,氨气的体积分数减小,根据图知,温度T1<T2<T3,温度越高化学平衡常数越小,所以化学平衡常数K1>K2>K3,故答案为:K1>K2>K3;
③若体系在T2、60MPa下达到平衡,相同温度下,气体的体积分数等于其物质的量分数,
设平衡时n(NH3)=xmol,
N2(g) + 3H2(g)2NH3(g)
开始(mol) 9 23 0
反应(mol) 0.5x 1.5x x
平衡(mol)9-0.5x 23-1.5x x
平衡时氨气体积分数=![]() ×100%=60%,x=12,氮气分压=
×100%=60%,x=12,氮气分压=![]() ×60MPa=9MPa;氨气的分压=60%×60MPa=36MPa,氢气分压=60MPa-9MPa-36MPa=15MPa,此时的平衡常数Kp=
×60MPa=9MPa;氨气的分压=60%×60MPa=36MPa,氢气分压=60MPa-9MPa-36MPa=15MPa,此时的平衡常数Kp=![]() =0.043(MPa)-2,故答案为:9;0.043(MPa)-2。
=0.043(MPa)-2,故答案为:9;0.043(MPa)-2。

【题目】在2 L恒容密闭容器中,800 ℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)图中表示NO2的变化的曲线是________。
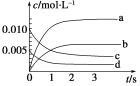
(2)能说明该反应已经达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v(NO)逆=2v(O2)正
d.容器内的密度保持不变
(3)能够使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体
b.增大O2的浓度
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 最外层电子数是电子层数的两倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,该核素的原子核内有8个中子,则这种同位素的符号是________。
(2)元素Y的单质的电子式为_________________,元素Y和元素Z可形成一种各原子最外层均为8电子结构的化合物,该化合物的结构式为 ___________
(3)元素X与元素T相比,非金属性较强的是元素T,下列表述中不能证明这一事实的选项是_____。
a.常温下元素X的单质和元素T的单质的熔沸点不同
b.元素T的氢化物比元素X的氢化物稳定
c.元素X和元素T的单质都能在氧气中燃烧
d.元素T最高价氧化物对应水化物的酸性比元素X最高价氧化物对应水化物的酸性强
e.Na2XO3溶液呈碱性,Na2TO4溶液呈中性
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种酸的是_______________(用化学式表示)