题目内容
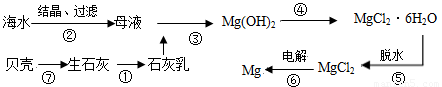
从海水中提取镁的工业生产流程如下:
海水
Mg(OH)2
MgCl2?6H2O
MgCl2
下列说法错误的是( )
海水
| 石灰乳 |
| ① |
| 盐酸、加热浓缩 |
| ② |
| HCl气体、△ |
| ③ |
| 电解 |
| ④ |
下列说法错误的是( )
| A、此法的优点之一是原料来源丰富 |
| B、该提取镁的过程中涉及置换、分解、复分解和氧化还原反应 |
| C、步骤①②③的目的是从海水中提取无水MgCl2 |
| D、步骤②中加盐酸的离子方程式为Mg(OH)2+2H+=Mg2++2H2O |
分析:提取镁的工艺流程中发生的反应有:CaCO3
CaO+CO2↑,CaO+H2O=Ca(OH)2,Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2
Mg+Cl2↑,此过程中不涉及置换反应.
| ||
| ||
解答:解:提取镁的过程中发生的反应有:CaCO3
CaO+CO2↑,CaO+H2O=Ca(OH)2,Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2
Mg+Cl2↑,
A.用到的原料碳酸钙、海水等来源丰富,故A正确;
B.由工艺流程原理,可知提取镁的过程中没有涉及置换原反应,故B错误;
C.由工艺流程可知,步骤①②③的目的是从海水中提取无水MgCl2,故C正确;
D.步骤②中加盐酸,与氢氧化镁反应生成氯化镁与水,反应离子方程式为Mg(OH)2+2H+=Mg2++2H2O,故D正确,
故选B.
| ||
| ||
A.用到的原料碳酸钙、海水等来源丰富,故A正确;
B.由工艺流程原理,可知提取镁的过程中没有涉及置换原反应,故B错误;
C.由工艺流程可知,步骤①②③的目的是从海水中提取无水MgCl2,故C正确;
D.步骤②中加盐酸,与氢氧化镁反应生成氯化镁与水,反应离子方程式为Mg(OH)2+2H+=Mg2++2H2O,故D正确,
故选B.
点评:本题考查海水资源开发利用、化学工艺流程等,理解工艺流程原理是关键,侧重对学生综合能力的考查,难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
从海水中提取镁的工业流程如下图所示,下列说法正确的是
| A.在实验室进行②的操作需用到坩埚、坩埚钳、玻璃棒、酒精灯 |
| B.步骤⑥电解MgCl2时,阴极产生H2 |
| C.步骤⑤应将晶体置于HCl气体氛围中脱水 |
| D.上述工艺流程中的反应未涉及氧化还原反应 |