题目内容
11.下列有关物质用途的叙述错误的是( )| A. | 氯气可用于自来水消毒 | |
| B. | 40%的甲醛水溶液可用作防腐剂,浸制生物标本 | |
| C. | 工业酒精可用于酿造饮用酒 | |
| D. | 食盐中添加碘酸钾(KIO3)加工碘盐 |
分析 A.氯气与水反应生成次氯酸具有强氧化性;
B.甲醛能够使蛋白质变性;
C.工业酒精含有甲醇,甲醇有毒;
D.碘酸钾无毒;
解答 解:A.氯气与水反应生成次氯酸具有强氧化性,能够杀菌消毒,故A正确;
B.甲醛能够使蛋白质变性,40%的甲醛水溶液可用作防腐剂,可以用来浸制生物标本,故B正确;
C.工业酒精含有甲醇,甲醇有毒,不能用工业酒精造酒,故C错误;
D.食盐中添加碘酸钾(KIO3)加工碘盐可以补充碘,故D正确;
故选:C.
点评 本题考查了物质的用途,性质决定用途,明确相关物质的性质是解题关键,注意食品添加剂等人体食用的物品不能对人体造成伤害,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
2.下列有关研究物质性质的方法和程序的说法中,不正确的是( )
| A. | 研究物质的性质时,常用到观察、实验、分类、比较、模型、假设等方法 | |
| B. | 研究物质性质的一般程序的第二步是观察物质的外观 | |
| C. | 可以用分类的方法预测物质的性质 | |
| D. | 观察是一种有计划、有目的地用感官考察研究对象的方法 |
19.下列离子方程式书写正确的是( )
| A. | 实验室用大理石和稀盐酸制取CO2 气体 CO32-+2H+═CO2↑+H2O | |
| B. | 氧化钠和盐酸 O2-+2H+═H2O | |
| C. | 澄清石灰水和稀盐酸 OH-+H+═H2O | |
| D. | 铜和稀硫酸 Cu+2 H+═Cu2++H2↑ |
6.下列实验操作中错误的是( )
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,萃取剂的密度不一定比水大 |
16.用水稀释0.1mol/L的醋酸溶液,其中随水的量增加而增大的是( )
①c(H+)②n(H+) ③$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$④$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$⑤c(OH-) ⑥c(CH3COO-)
①c(H+)②n(H+) ③$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$④$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$⑤c(OH-) ⑥c(CH3COO-)
| A. | ①②③ | B. | ②③⑤ | C. | ④⑤ | D. | ④⑤⑥ |
3.室温下将a mL三种一元酸分别和NaOH溶液等体积混合,实验数据如表:
(1)上述这三种酸中一定属于强酸的是HY,丙组实验发生反应的离子方程式为HZ+OH-═H2O+Z-,所得溶液中由水电离出的c(OH-)=mol•L-1.
(2)部分实验反应过程中的pH变化曲线如图:

①表示乙组实验的pH变化曲线是图1(填“图1”或“图2”)
②以上两图中表示溶液恰好完全反应的点是BE.
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,所得溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L
②c(OH-)=1.0×10-3 mol•L-1的氨水c L
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.则a、b、c、d的大小关系是b>a=d>c.
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图3中表示醋酸溶液中pH变化曲线的是B(填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1 <m2(填“<”、“=”、“>”)
| 组别 | c(一元酸) | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | c(HX)=0.1mol•L-1 | 0.1 | pH=x |
| 乙 | c(HY)=0.1mol•L-1 | 0.1 | pH=7 |
| 丙 | c(HZ)=0.1mol•L-1 | 0.1 | pH=9 |
(2)部分实验反应过程中的pH变化曲线如图:

①表示乙组实验的pH变化曲线是图1(填“图1”或“图2”)
②以上两图中表示溶液恰好完全反应的点是BE.
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,所得溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L
②c(OH-)=1.0×10-3 mol•L-1的氨水c L
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.则a、b、c、d的大小关系是b>a=d>c.
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图3中表示醋酸溶液中pH变化曲线的是B(填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1 <m2(填“<”、“=”、“>”)
20.如图是某只含有C、H、O元素的有机物简易球棍模型.下列关于该有机物的说法正确的是( )
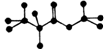

| A. | 该物质在酸性条件下水解生成乙酸 | |
| B. | 该物质含有双键,能跟氢气发生加成反应 | |
| C. | 该物质属于酯类 | |
| D. | 分子式为C3H8O2 |
10.一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2+O2?2SO3,其起始物质的量及SO2的平衡转化率如下表所示.下列判断中正确的是( )
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
| A. | 甲中反应的平衡常数小于乙 | |
| B. | 该温度下,该反应的平衡常数K为400 | |
| C. | SO2的平衡转化率:α1>α2=α3 | |
| D. | 容器中SO3的物质的量浓度:丙=丁<甲 |