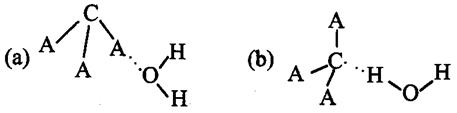题目内容
[化学一一选修物质结构与性质]
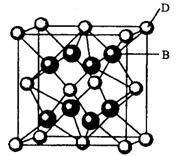
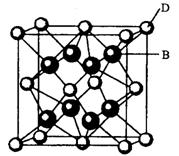
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示。请回答下列问题。
(1)E元素原子基态时的电子排布式为 ;
(2)A2F分子中F原子的杂化类型是 ,F的氧化物FO3分子空间构型为 ;
(3)CA3极易溶于水,其原因主要是 ![]() ,试判断CA3溶于水后,形成CA3·H2O的合理结构 (填字母代号),推理依据是:
,试判断CA3溶于水后,形成CA3·H2O的合理结构 (填字母代号),推理依据是:
。

(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合物晶体的密度为ag·cm-3。,则晶胞的体积是 (写出表达式即可)。
(1)1s22s22p63s23p63d104s1或[Ar]3d104s1(2分)
(2)sp3(2分) 平面正三角形(2分)
(3)与水分子间形成氢键(2分)b(2分)
一水合氨电离产生铵根离子和氢氧根(1分)
(4)CaF2(2分)![]() (2分)
(2分)
解析:

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2011?丹东模拟) 化学一一选修物质结构与性质
(2011?丹东模拟) 化学一一选修物质结构与性质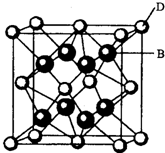 【化学一一选修物质结构与性质】
【化学一一选修物质结构与性质】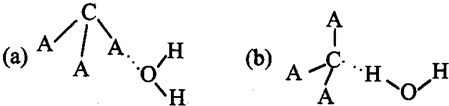
 ,试判断CA3溶于水后,形成CA3·H2O的合理结构 (填字母代号),推理依据是:
,试判断CA3溶于水后,形成CA3·H2O的合理结构 (填字母代号),推理依据是: