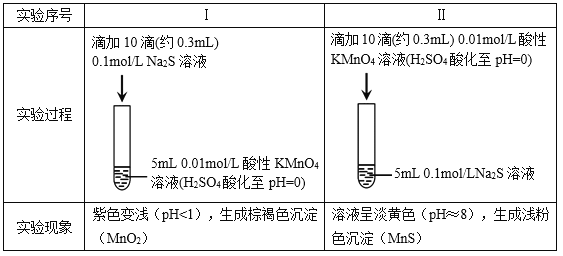
ЬтФПФкШн
ЁОЬтФПЁПвбжЊАБЦјдкЩњЛюЁЂЩњВњЁЂПЦбажагаМЋЙуЗКгУЭОЁЃ
ЃЈ1ЃЉвбжЊЗДгІЂёЃК2NH3ЃЈgЃЉ+CO2ЃЈgЃЉЈTNH2CO2NH4ЃЈsЃЉЁїH=Љ159.5kJ/mol
ЗДгІЂђЃКNH2CO2NH4ЃЈsЃЉЈTCOЃЈNH2ЃЉ2 ЃЈsЃЉ+H2OЃЈgЃЉЁїH= + 116.5kJ/mol
ЗДгІЂѓЃКH2OЃЈlЃЉЈTH2OЃЈgЃЉЁїH= + 44.0kJ/mol
ЙЄвЕЩЯвдCO2ЁЂNH3ЮЊдСЯКЯГЩФђЫиКЭвКЬЌЫЎЕФШШЛЏбЇЗНГЬЪНЮЊ___________________ЃЌИУЗДгІдк_________ЬѕМўЯТПЩвдздЗЂНјааЃЈЬюЁАИпЮТЁБЁЂЁАЕЭЮТЁБЛђЁАШЮКЮЮТЖШЯТЁБЃЉЃЛ
ЃЈ2ЃЉВщдФзЪСЯПЩжЊЃКГЃЮТЯТЃЌKЮШ[AgЃЈNH3ЃЉ2+]=1.00ЁС107ЃЌKsp[AgCl]=2.50ЁС10Љ10ЃЎ
ЂйвјАБШмвКжаДцдкЦНКтЃКAg+ЃЈaqЃЉ+2NH3ЃЈaqЃЉ![]() AgЃЈNH3ЃЉ2+ ЃЈaqЃЉЃЌИУЗДгІЦНКтГЃЪ§ЕФБэДяЪНЮЊKЮШ=_______________ЃЛ
AgЃЈNH3ЃЉ2+ ЃЈaqЃЉЃЌИУЗДгІЦНКтГЃЪ§ЕФБэДяЪНЮЊKЮШ=_______________ЃЛ
ЂкМЦЫуЕУЕНПЩФцЗДгІAgCl ЃЈsЃЉ+2NH3ЃЈaqЃЉ![]() AgЃЈNH3ЃЉ2+ ЃЈaqЃЉ+ClЉЃЈaqЃЉЕФЛЏбЇЦНКтГЃЪ§K=_________________________ЃЛдк1LХЈЖШЮЊ1mol/LАБЫЎжазюЖрПЩвдШмНтAgClЮЊ_______molЃЈБЃСє2ЮЛгааЇЪ§зжЃЉЁЃ
AgЃЈNH3ЃЉ2+ ЃЈaqЃЉ+ClЉЃЈaqЃЉЕФЛЏбЇЦНКтГЃЪ§K=_________________________ЃЛдк1LХЈЖШЮЊ1mol/LАБЫЎжазюЖрПЩвдШмНтAgClЮЊ_______molЃЈБЃСє2ЮЛгааЇЪ§зжЃЉЁЃ
ЁОД№АИЁП 2NH3ЃЈgЃЉ+CO2ЃЈgЃЉ=CO(NH2)2 (s) +H2OЃЈlЃЉ ЁїH=Љ87 kJ/mol ЕЭЮТ K=  2.5ЁС10Љ3 0.045
2.5ЁС10Љ3 0.045
ЁОНтЮіЁПЃЈ1ЃЉЗДгІЂёЃЋЗДгІЂђЃЗДгІЂѓЕУЕНЃК2NH3ЃЈgЃЉ+CO2ЃЈgЃЉ=CO(NH2)2 (s) +H2OЃЈlЃЉ ЁїH=Љ87 kJ/molЁЃздЗЂЗДгІЕФвЊЧѓЪЧЃКЁїG=ЁїHЃTЁїsЃМ0ЁЃИУЗДгІНЋЦјЬхзЊЛЏЮЊШмвКжаШмжЪЃЌЫљвдЁїsЃМ0ЃЌЗДгІЕФЁїHЃМ0ЁЃгЩЩЯЃЌЮЊСЫЪЙЁїGаЁгк0ЃЌдђЮТЖШTдНЕЭдНгаРћЃЌМДИУЗДгІдкЕЭЮТЯТздЗЂЁЃ
ЃЈ2ЃЉЂйЗДгІЮЊЃКAg+ЃЈaqЃЉ+2NH3ЃЈaqЃЉ![]() AgЃЈNH3ЃЉ2+ ЃЈaqЃЉЃЌЫљвдЦНКтГЃЪ§БэДяЪНЮЊKЮШ=
AgЃЈNH3ЃЉ2+ ЃЈaqЃЉЃЌЫљвдЦНКтГЃЪ§БэДяЪНЮЊKЮШ= ЁЃ
ЁЃ
ЂкAgCl ЃЈsЃЉ+2NH3ЃЈaqЃЉ![]() AgЃЈNH3ЃЉ2+ ЃЈaqЃЉ+ClЉЃЈaqЃЉЕФЛЏбЇЦНКтГЃЪ§
AgЃЈNH3ЃЉ2+ ЃЈaqЃЉ+ClЉЃЈaqЃЉЕФЛЏбЇЦНКтГЃЪ§
![]()
дк 1LХЈЖШЮЊ1mol/LАБЫЎжаКЌга1molNH3ЃЌЩшФмШмНтXmolЕФAgClЁЃ
AgCl ЃЈsЃЉ+ 2NH3ЃЈaqЃЉ ![]() AgЃЈNH3ЃЉ2+ ЃЈaqЃЉ + ClЉЃЈaqЃЉ
AgЃЈNH3ЃЉ2+ ЃЈaqЃЉ + ClЉЃЈaqЃЉ
Ц№ЪМЃК 1 0 0
ШмНтЃК X 2X X X
ЦНКтЃК 1-2X X X
ЫљвдЃК  ЃЌНтЕУX=0.045ЁЃ
ЃЌНтЕУX=0.045ЁЃ