题目内容
【题目】已知A、B、C、D、E是短周期中的五种非金属元素,它们的原子序数依次增大.A元素原子形成的离子就是一个质子,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍.E元素与D元素同主族;E的单质为黄色晶体,易溶入CS2
(1)请写出元素符号:B;C;
(2)画出E的阴离子结构示意图:;
(3)A单质和C单质在一定条件下反应生成化合物X,该反应的化学方程式为;
(4)将9gB单质在足量的D单质中燃烧,所得气体通入1L 1mol/L的NaOH溶液中,完全吸收后,溶液中(除Na+外)浓度最大的离子是 .
【答案】
(1)C;N
(2)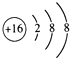
(3)N2+3H2 ![]() 2NH3
2NH3
(4)HCO ![]()
【解析】解:A、B、C、D、E是短周期中的5种非金属元素,它们的原子序数依次增大.A元素原子形成的离子就是一个质子,则A为H元素;B原子的最外层电子数是内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;E的单质为黄色晶体,易溶于二硫化碳,则E为S元素;E元素与D元素同主族,则D为O元素;C、D在元素周期表中处于相邻的位置,且D的原子序数大,则C为N元素.(1)由上述分析可知,B为C元素、C为N元素,所以答案是:C;N;(2)E的阴离子为S2﹣ , 离子结构示意图: 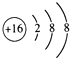 ,所以答案是:
,所以答案是: 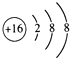 ;(3)A的单质为氢气、C的单质为氮气,二者在一定条件下反应生成化合物X为NH3 , 反应方程式为:N2+3H2
;(3)A的单质为氢气、C的单质为氮气,二者在一定条件下反应生成化合物X为NH3 , 反应方程式为:N2+3H2 ![]() 2NH3 , 所以答案是:N2+3H2
2NH3 , 所以答案是:N2+3H2 ![]() 2NH3;(4)9g碳单质的物质的量是
2NH3;(4)9g碳单质的物质的量是 ![]() =0.75mol,完全燃烧生成CO2为0.75mol,NaOH的物质的量为1L×1mol/L=1mol,二氧化碳与氢氧化钠的物质的量之比为3:4,由CO2+NaOH=NaHCO3、CO2+2NaOH=Na2CO3+H2O可知,产物是Na2CO3、NaHCO3的混合物,令碳酸钠与碳酸氢钠的物质的量分别为xmol、ymol,根据碳元素守恒由x+y=0.75,根据钠元素守恒有2x+y=1,联立方程,解得x=0.25,y=0.5,离子水解程度微弱,故溶液中(除Na+外)浓度最大的离子是 HCO3﹣ , 所以答案是:HCO3﹣ .
=0.75mol,完全燃烧生成CO2为0.75mol,NaOH的物质的量为1L×1mol/L=1mol,二氧化碳与氢氧化钠的物质的量之比为3:4,由CO2+NaOH=NaHCO3、CO2+2NaOH=Na2CO3+H2O可知,产物是Na2CO3、NaHCO3的混合物,令碳酸钠与碳酸氢钠的物质的量分别为xmol、ymol,根据碳元素守恒由x+y=0.75,根据钠元素守恒有2x+y=1,联立方程,解得x=0.25,y=0.5,离子水解程度微弱,故溶液中(除Na+外)浓度最大的离子是 HCO3﹣ , 所以答案是:HCO3﹣ .