题目内容
【题目】乳酸亚铁晶体[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288;易溶于水,是一种很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与FeCO3反应制得。
I.碳酸亚铁的制备(装置如图所示)
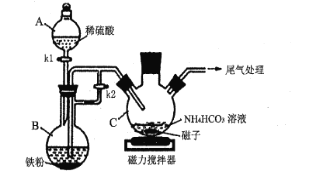
(1)仪器C的名称是____;实验操作如下:打开kl、k2,加入适量稀硫酸,关闭kl,使反应进行一段时间,其目的是____。
(2)接下来关闭k2使仪器C中的制备反应发生,其反应的离子方程式为__。
Ⅱ.乳酸亚铁的制备及铁元素含量测定
(3) 仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是____。
向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在隔绝空气的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(4)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于l00%,其原因可能是 ___。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol.L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液____,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为23. 80 mL,则样品纯度为____%(保留1位小数)。
【答案】三颈烧瓶 生成FeSO4溶液,且用产生的H2排尽装置内的空气 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 取最后一次洗涤液,加入稀盐酸酸化,再滴入BaCl2溶液,若无白色沉淀,则洗涤干净 乳酸根离子中的羟基也能被高锰酸钾氧化,导致消耗高锰酸钾溶液用量偏多 蓝色褪去且半分钟不恢复 91.4%
【解析】
I.亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与稀硫酸反应制备硫酸亚铁,利用Fe与稀硫酸反应生成的氢气排尽装置中的空气;关闭K2,B中生成氢气,使B装置中气压增大,将B装置中的硫酸亚铁溶液压入C中。C装置中硫酸亚铁和NH4HCO3发生反应产生FeCO3沉淀。
Ⅱ.(3)FeCO3是从含有SO42-的溶液中过滤出来的,可通过检验最后一次洗涤液是否含有SO42-判断。
(4)①乳酸和亚铁离子都可被酸性高锰酸钾氧化;
②滴定终点时,I2完全被硫代硫酸钠还原;根据已知反应可得关系式2Fe3+~~I2~~2S2O32-计算样品纯度。
I. (1)由仪器图形可知C为三颈烧瓶;打开kl、k2,加入适量稀硫酸,Fe与稀硫酸反应制备硫酸亚铁,且用B中产生的H2排尽装置内的空气,防止二价铁被氧化;
(2)待装置内空气排出后,再关闭k2,反应产生的氢气使装置内的气体压强增大,可将B中生成的硫酸亚铁溶液排到装置C中,发生反应生成碳酸亚铁,同时生成二氧化碳,反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(3)FeCO3是从含有SO42-的溶液中过滤出来的,可通过检验最后一次洗涤液是否含有SO42-判断。方法是:取最后一次水洗液于试管中,加入过量稀盐酸酸化,滴加一定量的BaCl2溶液,若无白色浑浊出现,则表明洗涤液中不存在SO42-,即可判断FeCO3沉淀洗涤干净;
Ⅱ.(4)①乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,Fe2+也可以被氧化,因此二者反应都消耗KMnO4溶液,导致消耗高锰酸钾的量增大,使计算所得乳酸亚铁的质量偏大,产品中乳酸亚铁的质量分数会大于100%;
②I2遇淀粉溶液显蓝色,滴加硫代硫酸钠溶液,I2与Na2S2O3发生了氧化还原反应,当蓝色刚好褪去且半分钟不恢复,即可判断为滴定终点;23.80 mL 0.1000mol/L硫代硫酸钠溶液中硫代硫酸钠的物质的量为n(Na2S2O3)=0.02380L×0.100mol/L=2.38×10-3mol,根据关系式2Fe2+~2Fe3+~I2~2S2O32-,可知样品中CH3CH(OH)COO]2Fe3H2O的物质的量为n(Fe2+)=n(S2O32-)=2.38×10-3mol×![]() =9.52×10-3mol,则样品的纯度为
=9.52×10-3mol,则样品的纯度为![]() ×100%=91.4%。
×100%=91.4%。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以纯铜屑为原料制取的流程如下:
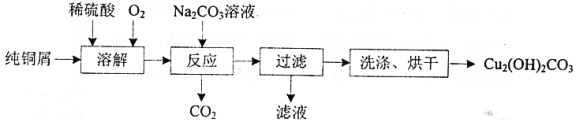
(1)“溶解”步骤反应的离子方程式为_______.温度宜控制在50℃左右,若高于50℃,溶液中O2溶解量减少、Cu的转化率降低,若低于50℃ ,_____
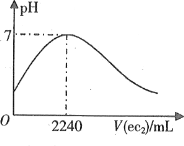
(2)“反应”步骤生成Cu2(OH)2CO3的化学方程式为_________。反应后溶液中铜元素残留量受pH和反应时间的影响如图所示:
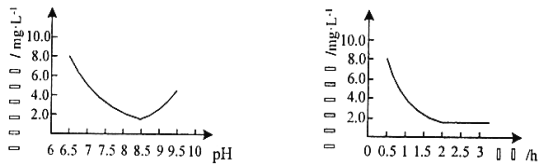
判断反应的最佳条件: pH为___、反应时间为____h。
(3)检验Cu2(OH)2CO3洗涤是否完全的方法是____________________
(4) Cu2(OH)2CO3也可以表示为CuCO3·Cu(OH)2。 查阅文献,上述反应条件下还可能生成少量CuCO3·Cu(OH)2。为测定产品的纯度[产品中Cu2(OH)2CO3的质量分数],取10.97g干燥样品,400℃左右加热,测得固体质量随时间变化关系如图所示。
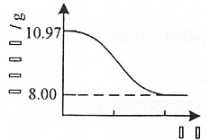
已知: 8.00g固体为黑色纯净物。
有关物质的摩尔质量如表:
物质 | CuCO3·Cu(OH)2 | CuCO3·2Cu(OH)2 | CuO |
摩尔质量/g·mol-1 | 222 | 320 | 80 |
请计算产品的纯度(写出计算过程,结果保留3位有效数字)。______