题目内容
【题目】乙酸是生活中常见的有机物之一,不仅是食醋的主要成分,在工业上也可用于制氢,已知如下反应:
热裂解反应:![]()
![]()
脱羧基反应:![]()
![]()
合成乙酸反应:![]()
![]()
(1)请写出![]() 与
与![]() 甲醇化的热化学方程式________。
甲醇化的热化学方程式________。
(2)在密闭容器中,利用乙酸制甲烷,若要使甲烷的产率较高,制备时选择的适宜条件为________。
a.较低温度 b.较大压强 c.高温 d.低压
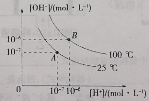
(3)向一恒容密闭容器充入一定量的乙酸气体发生反应,相同时间后,测得温度与气体产率的关系如图:
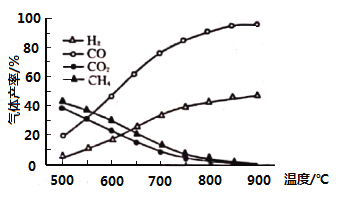
①约![]() 之前氢气产率低于甲烷的可能原因是________。而
之前氢气产率低于甲烷的可能原因是________。而![]() 之后氢气产率高于甲烷的理由是________。
之后氢气产率高于甲烷的理由是________。
②一定温度下,若在充入容器的乙酸气体中掺杂一定量水蒸气,氢气产率显著提高而![]() 产率下降,原因是________(用化学方程式表示)。
产率下降,原因是________(用化学方程式表示)。
(4)温度为![]() 时,在密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为
时,在密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为![]() ,热裂解反应消耗乙酸
,热裂解反应消耗乙酸![]() ,脱羧基反应消耗乙酸
,脱羧基反应消耗乙酸![]() ,乙酸的体积分数为________;脱羧基反应的平衡常数
,乙酸的体积分数为________;脱羧基反应的平衡常数![]() =________
=________![]() (
(![]() 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
【答案】![]()
![]() ad 脱羧基反应活化能低, 反应速率快 随着温度升高后, 热裂解反应速率加快, 同时热裂解反应正向移动, 而脱羧基反应逆向移动, 故氢气产率高于甲烷( 合理即可)
ad 脱羧基反应活化能低, 反应速率快 随着温度升高后, 热裂解反应速率加快, 同时热裂解反应正向移动, 而脱羧基反应逆向移动, 故氢气产率高于甲烷( 合理即可) ![]()
![]()
![]()
【解析】
(1)根据盖斯定律书写热化学方程式;
(2)根据影响化学平衡的因素分析;
(3)根据影响化学反应速率和化学平衡移动的因素分析;
(4)根据阿伏加德罗定律:压强之比等于物质的量之比进行解答。
(1)由反应①![]()
![]() ;
;
②![]()
![]() ;
;
③![]()
![]()
根据盖斯定律,可知:①+③CH3OH![]() CO(g)+2H2(g)
CO(g)+2H2(g)![]() H=+90.0kJ/mol,所以
H=+90.0kJ/mol,所以![]() 与
与![]() 甲醇化的热化学方程式
甲醇化的热化学方程式![]()
![]() ,故答案:
,故答案:![]()
![]() ;
;
(2)根据脱羧基反应:![]()
![]() 可知:脱羧基反应是一个气体体积增大的放热反应,所以要使甲烷产率较高,应控制较低温度和较低压强,故答案:ad;
可知:脱羧基反应是一个气体体积增大的放热反应,所以要使甲烷产率较高,应控制较低温度和较低压强,故答案:ad;
(3)①由已知热裂解反应:![]()
![]() ;脱羧基反应:
;脱羧基反应:![]()
![]() 可知,
可知,![]() 之前,氢气产率低于甲烷,可能原因是脱羧基反应为放热反应,活化能低,反应速率快;而之后随温度升高后,热裂解反应是吸热反应,热裂解反应速率加快,同时热裂解反应正向移动,脱羧基反应逆向移动,故氢气产率会高于甲烷,故答案:脱羧基反应活化能低,反应速率快;
之前,氢气产率低于甲烷,可能原因是脱羧基反应为放热反应,活化能低,反应速率快;而之后随温度升高后,热裂解反应是吸热反应,热裂解反应速率加快,同时热裂解反应正向移动,脱羧基反应逆向移动,故氢气产率会高于甲烷,故答案:脱羧基反应活化能低,反应速率快;
随着温度升高后,热裂解反应速率加快,同时热裂解反应正向移动,而脱羧基反应逆向移动,故氢气产率高于甲烷;
②在乙酸气体中掺杂水蒸气可发生反应![]() ,所以
,所以![]() 产率下降而
产率下降而![]() 产率提高,故答案:
产率提高,故答案:![]() ;
;
(4)根据已知:密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为![]() ,热裂解反应消耗乙酸
,热裂解反应消耗乙酸![]() ,脱羧基反应消耗乙酸
,脱羧基反应消耗乙酸![]() ,设充入乙酸的物质的量为
,设充入乙酸的物质的量为![]() , 达平衡时各物质的物质的量为:
, 达平衡时各物质的物质的量为:
脱羧基反应:![]()
反应消耗 ![]()
达平衡时 ![]()
![]()
热裂解反应: ![]()
反应消耗 ![]()
达平衡时 ![]()
![]()
反应后总物质的量为 ![]()
乙酸的体积分数为![]() ,脱羧基反应
,脱羧基反应![]() 的气体分压为
的气体分压为![]() ,
, 。故答案:
。故答案:![]() ;
;![]() 。
。

【题目】下表是甲、乙、丙、丁四种有机物的有关信息:
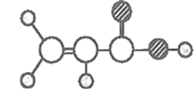
甲 | ①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成丙; ③比例模型为 |
乙 | ①由C、H两种元素组成; ②比例模型为 |
丙 | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与丁反应生成相对分子质量为100的酯 |
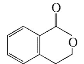
丁 | ①由C、H、O三种元素组成; ②球棍模型为 |
回答下列问题:
(1)甲与溴的四氯化碳溶液反应的生成物的结构简式是__。
(2)乙具有的性质是__(填序号)。
A.无色无味液体,有毒
B.不溶于水,密度比水的大
C.不能使酸性KMnO4溶液褪色
D.任何条件下不与氢气反应
(3)丙的官能团的名称:__;写出丙与Na反应的化学方程式:__。
(4)甲与氢气发生加成反应后生成物质戊,与戊在结构上相似的有机物有一大类(即“同系物”),它们均符合通式CnH2n+2。当n≥__时,这类有机物出现同分异构现象。
(5)丙与丁反应能生成相对分子质量为100的酯,该反应的反应类型为__;其化学方程式为___。
【题目】下列实验方案不能达到预期目的的是
实验方案 | 实验目的 | |
A | 向两支试管中分别加入 | 探究 |
B | 取 | 配制8%的 |
C | 将 | 比较 |
D | 测同温同浓度 | 比较硫和硅两元素非金属性强弱 |
A.AB.BC.CD.D