题目内容
标况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准碳酸钠溶液滴定这种盐酸时,碳酸钠溶液应装在
(2)现配制三种浓度的标准碳酸钠溶液,你认为最合适的是下列第
①2.500mol/L ②0.25mol/L ③0.025mol/L
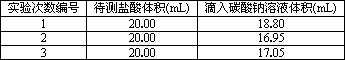
(3)若采用上述合适的标准碳酸钠溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
求这种待测稀盐酸的物质的量浓度(用题中所给数据列出计算式即可).c(HCl)=
(4)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度
(1)用标准碳酸钠溶液滴定这种盐酸时,碳酸钠溶液应装在
碱
碱
式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从红
红
色变成橙
橙
色.(2)现配制三种浓度的标准碳酸钠溶液,你认为最合适的是下列第
③
③
种.①2.500mol/L ②0.25mol/L ③0.025mol/L
(3)若采用上述合适的标准碳酸钠溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
| 实验次数编号 | 待测盐酸体积(mL) | 滴入碳酸钠溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
C(HCl)=
×
mol×L-1
| 2×C(Na2CO3) |
| 20.00 |
| (16.95+17.05) |
| 2 |
C(HCl)=
×
mol×L-1
.| 2×C(Na2CO3) |
| 20.00 |
| (16.95+17.05) |
| 2 |
(4)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度
偏高
偏高
,若滴定完毕后读数时俯视,则实验误差为偏低
偏低
(以上两空填“偏高”、“偏低”或“无影响”)分析:(1)碳酸钠溶液呈碱性,用碱式滴定管盛装碳酸钠溶液;滴定终点时,溶液颜色由红色变为橙色且半分钟内不变色;
(2)根据待测液的大致浓度来分析;
(3)舍去标准碳酸钠溶液滴定体积的不合理数据,求出碳酸钠溶液的平均体积,然后根据2HCl~Na2CO3求稀盐酸的物质的量浓度;
(4)根据c(待测)=
来分析.
(2)根据待测液的大致浓度来分析;
(3)舍去标准碳酸钠溶液滴定体积的不合理数据,求出碳酸钠溶液的平均体积,然后根据2HCl~Na2CO3求稀盐酸的物质的量浓度;
(4)根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
解答:解:(1)碳酸钠溶液呈碱性,用碱式滴定管盛装碳酸钠溶液;滴定终点时,溶液颜色由红色变为橙色且半分钟内不变色;故答案为:碱式;红色;橙色;
(2)HCl的大致浓度为
mol/L=0.045mol/L,标准碳酸钠溶液应选0.025mol/L,故选:③;
(3)(3)舍去第一组数据,碳酸钠溶液的平均体积为
,
2HCl~Na2CO3
2 1
C(HCl)×20.00mL 0.025mol/L×
C(HCl)=
×
mol×L-1
故答案为:C(HCl)=
×
mol×L-1;
(4)盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,标准液的浓度降低,造成V(标准液)偏大,根据c(待测)=
可知c(待测)偏高;滴定完毕后读数时俯视,造成V(标准液)偏小,根据c(待测)=
可知c(待测)偏小,故答案为:偏高;偏低.
(2)HCl的大致浓度为
| 1 |
| 22.4 |
(3)(3)舍去第一组数据,碳酸钠溶液的平均体积为
| 16.95+17.05 |
| 2 |
2HCl~Na2CO3
2 1
C(HCl)×20.00mL 0.025mol/L×
| 16.95+17.05 |
| 2 |
C(HCl)=
| 2×C(Na2CO3) |
| 20.00 |
| (16.95+17.05) |
| 2 |
故答案为:C(HCl)=
| 2×C(Na2CO3) |
| 20.00 |
| (16.95+17.05) |
| 2 |
(4)盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,标准液的浓度降低,造成V(标准液)偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
点评:本题考查中和滴定操作、计算及误差分析,注意利用公式来分析解答,无论哪一种类型的误差,都可以归结为对标准溶液体积的影响,其标准溶液的体积偏小,那么测得的物质的量的浓度也偏小;其标准溶液的体积偏大,那么测得的物质的量的浓度也偏大.

练习册系列答案
相关题目
标况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准碳酸钠溶液滴定这种盐酸时,碳酸钠溶液应装在______式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从______色变成______色.
(2)现配制三种浓度的标准碳酸钠溶液,你认为最合适的是下列第______种.
①2.500mol/L ②0.25mol/L ③0.025mol/L
(3)若采用上述合适的标准碳酸钠溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
求这种待测稀盐酸的物质的量浓度(用题中所给数据列出计算式即可).c(HCl)=______.
(4)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度______,若滴定完毕后读数时俯视,则实验误差为______(以上两空填“偏高”、“偏低”或“无影响”)
(1)用标准碳酸钠溶液滴定这种盐酸时,碳酸钠溶液应装在______式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从______色变成______色.
(2)现配制三种浓度的标准碳酸钠溶液,你认为最合适的是下列第______种.
①2.500mol/L ②0.25mol/L ③0.025mol/L
(3)若采用上述合适的标准碳酸钠溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
| 实验次数编号 | 待测盐酸体积(mL) | 滴入碳酸钠溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
(4)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度______,若滴定完毕后读数时俯视,则实验误差为______(以上两空填“偏高”、“偏低”或“无影响”)