题目内容
将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为bg?cm-3,则该盐酸的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:计算题
分析:根据n=
计算氯化氢的物质的量,再根据m=nM计算氯化氢质量,溶液的质量=1000g+m(HCl),结合密度求出溶液的体积,根据物质的量浓度公式c=
计算溶液的物质的量浓度.
| V |
| Vm |
| n |
| V |
解答:
解:将标准状况下的a L HCl(气)的物质的量为
=
mol.
氯化氢的质量为
mol×36.5g/mol=
g.
所以溶液质量为1000g+
g=(1000+
)g.
所以溶液的体积为
=
L.
所以溶液浓度为
=
mol/L.
故选A.
| aL |
| 22.4L/mol |
| a |
| 22.4 |
氯化氢的质量为
| a |
| 22.4 |
| 36.5a |
| 22.4 |
所以溶液质量为1000g+
| 36.5a |
| 22.4 |
| 36.5a |
| 22.4 |
所以溶液的体积为
(1000+
| ||
| 1000bg/L |
| 22400+36.5a |
| 22400b |
所以溶液浓度为
| ||
|
| 1000ab |
| 22400+36.5a |
故选A.
点评:本题考查物质的量浓度的相关计算与理解,正确计算溶液的体积是解本题的关键,也可以利用质量分数与物质的量浓度关系计算.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
汽车尾气净化中的一个反应如下:NO(g)+CO(g)?
N2(g)+CO2 (g)△H=-373.4kJ.mol-1若反应在恒容的密闭容器中达到平衡状态,下列有关说法正确的是( )
| 1 |
| 2 |
| A、其它条件不变,加入催化剂,△H变大 |
| B、及时除去二氧化碳,正反应速率加快 |
| C、降低温度,可提高反应物的转化率 |
| D、若气体的密度保持不变,说明平衡不发生移动 |
下列叙述中正确的是( )
| A、氧化还原反应的本质是化合价发生变化 |
| B、有单质产生的分解反应一定是氧化还原反应 |
| C、在同一氧化还原反应中,反应物和生成物中都有氧化剂 |
| D、还原剂在反应中失去电子发生还原反应 |
下列离子方程式正确的是( )
| A、向次氯酸钙溶液通入少量CO2:2ClO-+H2O+CO2=CO32-+2HClO |
| B、向明矾溶液中加入足量Ba(OH)2溶液:Al3++2SO42-+4OH-+2Ba2+=2BaSO4↓+[Al(OH)4]- |
| C、向FeCl3溶液中加入足量单质锌:Zn+2Fe3+=Zn2++2Fe2+ |
| D、向NaHSO4中滴加Ba(OH)2溶液至中性:H++SO42-+OH-+Ba2+=BaSO4↓+H2O |
在盛有50mL澄清饱和石灰水的小烧杯中放入一小块钠,不可能观察到的现象是( )
| A、钠熔化成银白色小球 |
| B、在液面快速游动 |
| C、溶液底部出现光亮的银白色固体 |
| D、溶液变浑浊 |

 (B2H6为乙硼烷)
(B2H6为乙硼烷)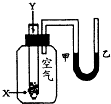 某学生用如右图所示的装置进行化学反应X+2Y→2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到试管中甲处液面下降,乙处液面上升.关于该反应的下列叙述正确的是( )
某学生用如右图所示的装置进行化学反应X+2Y→2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到试管中甲处液面下降,乙处液面上升.关于该反应的下列叙述正确的是( ) 如图所示,烧杯中都盛有稀硫酸:
如图所示,烧杯中都盛有稀硫酸: