题目内容
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题:
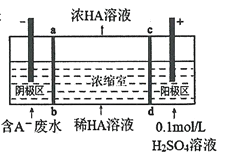
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如图所示。A包含物质为H2O和________(填化学式)。
(2)已知:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH1=-a kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH2=-b kJ·mol-1
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的ΔH=________ kJ·mol-1。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)![]() HCN(g)+3H2(g) ΔH>0。
HCN(g)+3H2(g) ΔH>0。
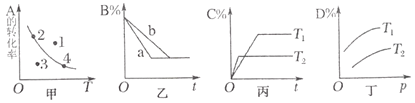
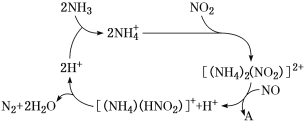
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是________(填字母)。
a.温度 b.压强 c.催化剂 d.![]()
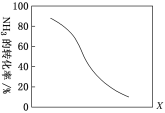
②在一定温度下,向2 L密闭容器中加入 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如下图所示。a点时,CH4的转化率为_______%;平衡常数:K(a)____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为Mb(aq)+O2(g) ![]() MbO2(aq),该反应的平衡常数可表示为K=
MbO2(aq),该反应的平衡常数可表示为K=![]() 。在37 ℃条件下达到平衡时,测得肌红蛋白的结合度(α)与p(O2)的关系如图所示。[α=
。在37 ℃条件下达到平衡时,测得肌红蛋白的结合度(α)与p(O2)的关系如图所示。[α=![]() ×100%]。研究表明正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。试求出图中c点时,上述反应的平衡常数K=________。已知k逆=60 s-1,则速率常数k正=________s-1。
×100%]。研究表明正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。试求出图中c点时,上述反应的平衡常数K=________。已知k逆=60 s-1,则速率常数k正=________s-1。

【答案】N2 - ![]() bd 25 = 2 120
bd 25 = 2 120
【解析】
(1)根据原子守恒分析、解答;
(2)根据盖斯定律,将已知热化学方程式叠加,可得待求反应的热化学方程式;
(3)①根据影响化学反应平衡的因素分析;
②a点时,n(CH4)=2 mol,平衡时NH3体积分数为30%,设转化CH4的物质的量为x,根据物质反应转化关系计算平衡时CH4的转化率,利用化学平衡常数K与温度关系分析;
(4)根据反应达到平衡时正、逆反应速率相等计算出k正、k逆与平衡常数K的关系;图示可知c点时p(O2)=4.5 kPa,α=![]() ×100%=90%,则生成的c(MbO2)=0.9c(Mb)初始,平衡时的c(Mb)=0.1 c(Mb)初始,据此计算,再根据①的结果可得k正。
×100%=90%,则生成的c(MbO2)=0.9c(Mb)初始,平衡时的c(Mb)=0.1 c(Mb)初始,据此计算,再根据①的结果可得k正。
(1)由图示有方程:[(NH4)2(NO2)]2++NO=[(NH4)(HNO2)]++A+H+,根据原子守恒,可得A为N2+H2O;
(2)已知:①4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H1=-a kJ/mol
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H2=-b kJ/mol
根据盖斯定律,将![]() ×(2×①+3×②)可得:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-
×(2×①+3×②)可得:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-![]() kJ/mol;
kJ/mol;
(3)①图象趋势为平衡时NH3转化率随外界条件X增大而减小。
a.该反应是吸热反应,温度升高平衡正向移动,NH3转化率随温度的升高而增大,与图形不符,a错误;
b.该反应是气体体积增大的反应,增大压强,化学平衡逆向移动,NH3转化率随压强增大而减小,与图形符合,b正确;
c.催化剂能同等倍数的影响正、逆反应速率,因此对化学平衡移动无影响,c错误;
d.![]() 越大,代表氨气的量越大,有利于正反应,但是氨气的转化率却随着氨气的增多而减小,与图形相符合,d正确;
越大,代表氨气的量越大,有利于正反应,但是氨气的转化率却随着氨气的增多而减小,与图形相符合,d正确;
故合理选项是bd;
②a点时,n(CH4)=2 mol,n(NH3)=2 mol,设转化CH4的物质的量为x,根据反应方程式CH4(g)+NH3(g)![]() HCN(g)+3H2(g)中物质反应转化关系可知:平衡时产生HCN的物质的量为x mol,H2的物质的量为3x mol,则平衡时剩余CH4(g)与NH3(g)的物质的量都是(2-x) mol,由于平衡时NH3体积分数为30%,所以
HCN(g)+3H2(g)中物质反应转化关系可知:平衡时产生HCN的物质的量为x mol,H2的物质的量为3x mol,则平衡时剩余CH4(g)与NH3(g)的物质的量都是(2-x) mol,由于平衡时NH3体积分数为30%,所以![]() =30%,解得x=0.5 mol,所以CH4的转化率=
=30%,解得x=0.5 mol,所以CH4的转化率=![]() ×100%=25%;
×100%=25%;
a点和b点温度相同,这两点的化学平衡常数也相同,即K(a)=K(b);
(4)已知正反应速率v正=k正c(Mb)p(O2),逆反应速率v逆=k逆c(MbO2),平衡时,v正=v逆,则k正c(Mb)p(O2)= k逆c(MbO2),![]() =K;
=K;
由图可知:c点时,p(O2)=4.5 kPa,α=![]() ×100%=90%,则生成的c(MbO2)=0.9c(Mb)初始,平衡时的c(Mb)=0.1c(Mb)初始,则K=
×100%=90%,则生成的c(MbO2)=0.9c(Mb)初始,平衡时的c(Mb)=0.1c(Mb)初始,则K=![]() =2 kPa-1;已知k逆=60 s-1,又K=
=2 kPa-1;已知k逆=60 s-1,又K=![]() =2,则速率常数k正=K·k逆=120 s-1kPa-1。
=2,则速率常数k正=K·k逆=120 s-1kPa-1。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
操作 | 现象 |
向盛有4gCaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5mL溶液a置于试管中,滴入两滴石蕊溶液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_____________。
②加入石蕊溶液后溶液褪色可能是因为溶液a中存在较多的_____________。
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2![]() CaO2。
CaO2。
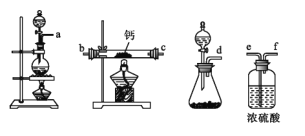
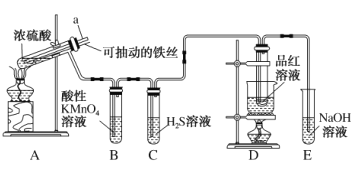
①请选择实验所需要的装置,按气流方向连接的顺序为_____________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_____________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应Ca2++H2O2+2NH3+8H2O=CaO28H2O↓+2![]() 在碱性环境下制取CaO2的装置如图所示。
在碱性环境下制取CaO2的装置如图所示。
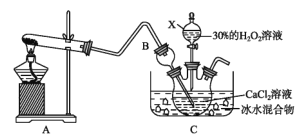
①NH3在Ca2+和H2O2的反应过程中所起的作用是_____________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO28H2O。过滤需要的玻璃仪器是_____________;将沉淀进行洗涤的操作为_____________。