题目内容
20.下列反应的离子方程式书写正确的是( )| A. | NaHCO3溶液中和盐酸:CO${\;}_{{3}_{\;}}$2-+2H+=H2O+CO2↑ | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O | |
| C. | 向碳酸氢铵溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 用MnS除去MnCl2溶液中的Cu2+:MnS+Cu2+=CuS+Mn2+ |
分析 A.碳酸氢根离子为多元弱酸的酸式根离子,不能拆;
B.得失电子不守恒;
C.氢氧化钠过量,反应生成碳酸钠、水和氨气;
D.依据沉淀转化书写离子方程式.
解答 解:A.NaHCO3溶液中和盐酸,离子方程式:HCO3-+H+=H2O+CO2↑,故A错误;
B.用稀硝酸洗涤试管内壁的银镜,离子方程式:3Ag+4H++NO3-=3Ag++NO↑+2H2O,故B错误;
C.向碳酸氢铵溶液中加过量的NaOH溶液并加热,离子方程式:HCO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CO32-,故C错误;
D.用MnS除去MnCl2溶液中的Cu2+,离子方程式:MnS+Cu2+=CuS+Mn2+,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子方程式应遵循客观事实、遵循原子个数、得失电子数守恒规律,注意反应物用量对反应的影响,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列物质中,属于可再生的能源是( )
| A. | 氢气 | B. | 石油 | C. | 煤 | D. | 天然气 |
8.甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)═CH3OH(g)△H1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
(1)已知
则△H1=-99kJ.mol-1
(2)图1中能正确表现反应①的平衡常数K随温度变化关系的曲线为a(填曲线标记字母),判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.
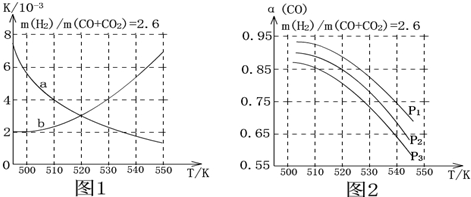
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示.α(CO)值随温度升高而减小(填“增大”或“减小”)原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小..图2中的压强由大到小为P1>P2>P3,判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高..
①CO(g)+2H2(g)═CH3OH(g)△H1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
(1)已知
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)图1中能正确表现反应①的平衡常数K随温度变化关系的曲线为a(填曲线标记字母),判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.

(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示.α(CO)值随温度升高而减小(填“增大”或“减小”)原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小..图2中的压强由大到小为P1>P2>P3,判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高..
12.某有机物分子式为C4H8,据此推测其结构和性质不可能的是( )
| A. | 含有3个甲基 | B. | 一氯代物只有一种 | ||
| C. | 使溴水褪色 | D. | 四个碳原子共平面 |
9.常温下,0.1mol•L-1 ROH溶液的pH=12.下列有关说法正确的是( )
| A. | c(OH-)=c(R+)=0.01mol•L-1 | B. | c(R+)>c(H+) | ||
| C. | c(ROH)<c(R+) | D. | c(ROH)<c(OH-) |

 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化: