题目内容
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是( )
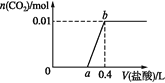
A.在0~a范围内,只发生H++OH-=H2O
B.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C.a=0.2
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
【答案】D
【解析】
盐酸滴加到氢氧化钠和碳酸钠的混合溶液中发生的反应顺序为:NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+H2O+CO2↑。
A. 在0~a范围内,发生的反应为:NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaCl+NaHCO3,A项错误;
B.根据上述分析可知ab段发生反应的离子方程式为:HCO3-+H+= H2O+CO2↑,B项错误;
C.根据纵坐标分析可知碳酸钠的物质的量为0.01mol,根据横坐标可知当产生的二氧化碳的物质的量为最大值时消耗的盐酸的物质的量为0.04mol,因此氢氧化钠的物质的量为0.02mol,故a=0.3L,C项错误;
D.根据C项分析可知原混合溶液中NaOH与Na2CO3的物质的量之比为2:1,D项正确。
故答案选D。

练习册系列答案
相关题目