题目内容
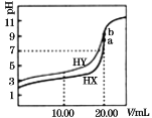
【题目】H2C2O4是一种二元弱酸。常温下向H2C2O4溶液中滴加KOH溶液,混合溶液中离子浓度与pH的关系如图所示,其中![]() 或
或![]() 。下列说法正确的是
。下列说法正确的是
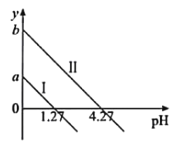
A.直线I表示的是![]() 与pH的变化关系
与pH的变化关系
B.图中纵坐标应该是a=1.27,b=4.27
C.c(![]() )>c(
)>c(![]() )>c(H2C2O4)对应1.27<pH<4.27
)>c(H2C2O4)对应1.27<pH<4.27
D.c(K+)=c(![]() )+c(
)+c(![]() )对应pH=7
)对应pH=7
【答案】B
【解析】
A. 二元弱酸草酸的![]() ,
,![]() ,当lgy=0时,pH=lgc(H+)=lgK,pH1=1.27<pH2=4.27,表明K1=101.27>K2=104.27,所以直线I表示的是
,当lgy=0时,pH=lgc(H+)=lgK,pH1=1.27<pH2=4.27,表明K1=101.27>K2=104.27,所以直线I表示的是![]() 与pH的变化关系,直线Ⅱ表示的是
与pH的变化关系,直线Ⅱ表示的是![]() 与pH的变化关系,故A错误;
与pH的变化关系,故A错误;
B. pH=0时,![]() ,
,![]() ,则图中纵坐标应该是a=1.27,b=4.27,故B正确;
,则图中纵坐标应该是a=1.27,b=4.27,故B正确;
C. 设pH=a,c(H+)=10a,![]() ,c(
,c(![]() )>c(
)>c(![]() ),104.27-a>1,则4.27-a>0,解得a<4.27,
),104.27-a>1,则4.27-a>0,解得a<4.27,![]() ,
,![]() ,当c(
,当c(![]() )>c(H2C2O4),102a-5.54>1,则2a-5.54>0,解得a>2.77,所以c(
)>c(H2C2O4),102a-5.54>1,则2a-5.54>0,解得a>2.77,所以c(![]() )>c(
)>c(![]() )>c(H2C2O4)对应2.77<pH<4.27,故C正确;
)>c(H2C2O4)对应2.77<pH<4.27,故C正确;
D. 电荷守恒:c(K+)+c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-),当c(K+)=c(
)+c(OH-),当c(K+)=c(![]() )+2c(
)+2c(![]() )时,c(H+)=c(OH-),对应pH=7,故D错误;
)时,c(H+)=c(OH-),对应pH=7,故D错误;
故选B。

练习册系列答案
相关题目