题目内容
2.1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一.下列有关元素周期表的说法正确的是( )| A. | 元素周期表含元素最多的族是第ⅢB族 | |
| B. | 元素周期表有18个族 | |
| C. | 第ⅠA族的元素全部是金属元素 | |
| D. | 长周期是指第四、五、六周期 |
分析 A.第ⅢB族含锕系元素和镧系元素;
B.元素周期表含7个主族、7个副族、1个第ⅤⅢ族,1个0族;
C.第ⅠA族的元素含H及碱金属元素;
D.长周期是指第四、五、六、七周期.
解答 解:A.第ⅢB族含锕系元素和镧系元素,则含元素最多的族是第ⅢB族,故A正确;
B.元素周期表含7个主族、7个副族、1个第ⅤⅢ族,1个0族,共16个族,故B错误;
C.第ⅠA族的元素含H及碱金属元素,H为非金属元素,故C错误;
D.短周期为一、二、三周期,长周期是指第四、五、六、七周期,故D错误;
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期、族及元素的位置为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列事实、事件、事故中与甲烷无关的是( )
| A. | 天然气的主要成分 | B. | 石油经过催化裂化的产物 | ||
| C. | “西气东输”中气体 | D. | 煤矿中的瓦斯爆炸 |
10.在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( )
| A. | K+、Na+、CO32-、NO3- | B. | NH4+、Al3+、SO42-、NO3- | ||
| C. | NH4+、K+、MnO4-、SO42- | D. | Ca2+、Na+、NO3-、HSO3- |
17.合成氨所需的氢气可由水煤气反应制得,其中的一步反应为:CO(g)+H2O(g)?CO2(g)+H2(g);△H=-43kJ•mol-1对于上述反应,下列措施中能提高CO转化率的是( )
| A. | 增大压强 | B. | 降低温度 | ||
| C. | 增大水蒸气的浓度 | D. | 增大CO的浓度 |
14.下列化学用语的书写,正确的是( )
| A. | 氯原子的结构示意图: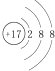 | |
| B. | 6个质子8个中子的碳元素的核素符号:12C | |
| C. | 氯化镁的电子式:[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]-Mg2+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| D. | 用电子式表示氯化氢的形成过程:H•+•$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$→H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- |
13.化学与社会、生活密切相关,对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
A | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 |
| B | 用氢氟酸蚀刻玻璃 | SiO2是碱性氧化物,能溶于酸 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 用浸有酸性高锰酸钾溶液的硅藻 土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| A. | A | B. | B | C. | C | D. | D |
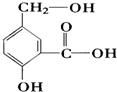

 .
.