题目内容
【题目】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
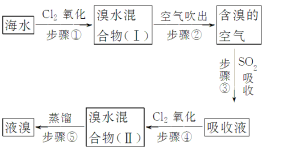
(1)步骤①反应的离子方程式是_____________________________。
(2)步骤③反应的化学方程式是______________________________。
(3)从理论上考虑,下列也能吸收Br2的是________。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
(4)步骤⑤蒸馏的过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:______________________。
【答案】2Br- + Cl2 ═ Br2 + 2Cl-SO2 + Br2 + H2O ═ 2HBr + H2SO4A B C温度过高,大量水蒸汽随溴排出,溴气中水增加,温度过低,溴不能完全蒸出,回收率低
【解析】
海水中通入氯气氧化溴离子得到溴水的混合溶液,用热空气吹出溴单质得到含溴的空气,通过二氧化硫吸收后富集溴元素得到吸收液,再通入氯气氧化溴化氢得到溴水的混合溶液,蒸馏得到溴单质,据此分析。
(1)海水中的溴离子容易被氯气氧化为溴的单质,氧化性氯气比溴强,步骤①反应的离子方程式为:2Br-+Cl2═Br2+2Cl-;
因此,本题正确答案是:2Br-+Cl2═Br2+2Cl-;
(2)溴单质有氧化性,二氧化硫具有还原性,溴和二氧化硫在水溶液中易发生氧化还原反应,步骤③反应的化学方程式为SO2+Br2+2H2O═H2SO4+2HBr,
因此,本题正确答案是:SO2+Br2+2H2O═H2SO4+2HBr;
(3)A.NaOH溶液和溴单质反应生成溴化钠、次溴酸钠和水,可以吸收,故A正确;
B.FeCl2溶液具有还原性,可以被溴单质氧化为氯化铁,可以吸收溴单质,故B正确;
C.Na2SO3溶液具有还原性,可以被溴单质氧化,能吸收溴单质,故C正确;
D.H2O和溴单质反应微弱,不能充分吸收溴单质,故D错误;
因此,本题正确答案是:ABC;
(4)溴的沸点是58.5°C,温度应控制在80~90℃最佳,温度控制过高,水会沸腾,溴蒸气中有水,温度过低,溴蒸气不易挥发,
因此,本题正确答案是:温度过高,大量水蒸汽随溴排出,溴气中水增加,温度过低,溴不能完全蒸出,回收率低。

【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。有人模拟用CO和H2合成甲醇,其反应为:CO(g) + 2H2(g) CH3OH(g) △H<0
(1)在容积固定为1L的密闭容器内充入2 mol CO和4 mol H2发生上述反应,20min时用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_________mol/(L·min),该温度下平衡常数K=___________,若平衡后增大压强,则K值_________(填“增大”、“减小”或“不变”)。
(2)在恒温恒容的密闭容器中,不能判定CO(g)+2H2(g) CH3OH(g) △H<0,反应达到平衡的是___________;
A、压强保持不变 B、气体的密度保持不变
C、气体平均摩尔质量保持不变 D、速率v(H2):v(CH3OH)=2:1
(3)如图是甲醇燃料电池结构示意图,C是________(填“正”或“负”)极,写出此电极的电极反应式__________________________________________。

(4)若以该电池为电源,用石墨做电极电解100mL CuSO4溶液,电解一段时间后,两极均收集到11.2L的气体(标准状况下),则原CuSO4溶液的物质的量浓度为________mol/L。


