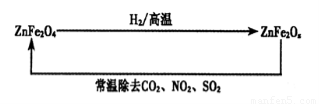
题目内容
已知KMnO4和H2C2O4在酸性溶液中发生反应:
KMnO4+ H2C2O4+ H2SO4 — K2SO4+ MnSO4+ CO2↑+ H2O(请配平)。
甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:
(1)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小,实验装置如图所示。
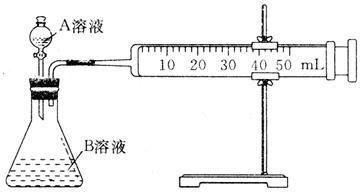
实验时A溶液一次性放下,A,B的成分见下表:
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 |
| ② | 2mL 0.2 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 |
| ③ | 2mL 0.2 mol·L-1L H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液、少量催化剂 |
该实验探究的是 对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是 (用实验序号填空)。
(2)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。取两支试管各加入2![]() 0.1
0.1![]() H2C2O4溶液,另取两支试管各加入4
H2C2O4溶液,另取两支试管各加入4![]() 0.1
0.1![]() KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
2 KMnO4+5H2C2O4+ 3 H2SO4 —— 1 K2SO4+ 2 MnSO4+ 10 CO2↑+ 8 H2O(2分)。
(1) 浓度和催化剂 , ③②① ; (2) 温度, KMnO4溶液过量

 阅读快车系列答案
阅读快车系列答案
 Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq)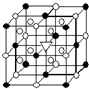 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子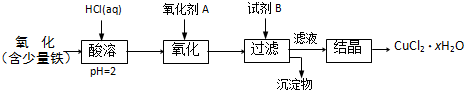
 和
和 ;“双烯合成反应”又称为“Diels-Alder反应”,如:
;“双烯合成反应”又称为“Diels-Alder反应”,如: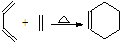 .
. ,则物质A的结构式为:
,则物质A的结构式为: 或CH2=CH-COOH
或CH2=CH-COOH
 中,D物质可发生反应生成一种生活中常用高分子,其化学方程式为:
中,D物质可发生反应生成一种生活中常用高分子,其化学方程式为:

 和
和 都是无色液体,下列物质中可以用来鉴别这两种物质的是
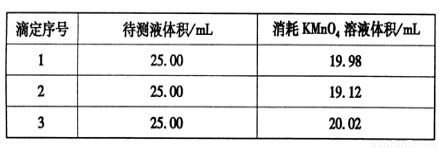
都是无色液体,下列物质中可以用来鉴别这两种物质的是 绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.
绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.