题目内容
[化学——选修化学与技术](15分)
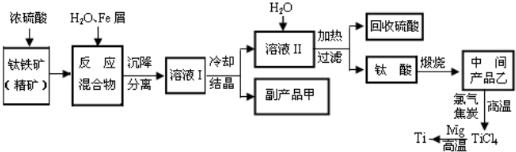
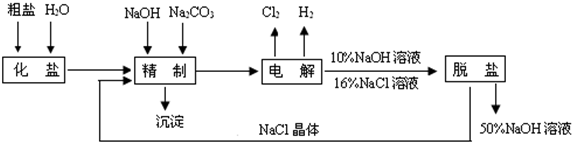
技术的发展与创新永无止境。我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下图所示:

(1)向沉淀池中要通入CO2和氨气,应先通入__________(填化学式),原因是__________。
(2)沉淀池中发生反应的化学方程式是__________。
(3)母液中的溶质主要是__________,向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是__________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了__________(填上述流程中的编号)的循环;物质x是__________,从沉淀池中提取沉淀的操作是__________。
(5)写出煅烧炉中发生反应的化学方程式__________。
(6)这样制得的产品碳酸钠中可能含有的杂质是__________(填化学式),为检验该杂质的存在,具体操作是__________。
【答案】
(1)NH3 (1分)因为CO2在NaCl溶液中的溶解度较小,而NH3极易溶于水 (2分)
(2)(2分)NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl
(3)(2分)NH4Cl 增大NH4+的浓度,使NH4Cl更多地析出
(4)(3分)循环Ⅰ(1分) CO2 (1分) 过滤(1分)
(5)(2分)2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(6)(3分) NaCl 取少量试样溶于水后,再滴加用硝酸酸化的AgNO3溶液,若有白色 沉淀生成,说明含NaCl杂质。(若没有“取少量试样”,则至少扣1分)
【解析】

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿