题目内容
A为中学化学常见金属单质,将A投入足量B的浓溶液中,溶液总质量在反应前后保持不变(忽略沉淀或气体的溶解).除A、C外其余各物质均含同一种元素X,F为X的氢化物,G为淡黄色固体,H为黑色沉淀
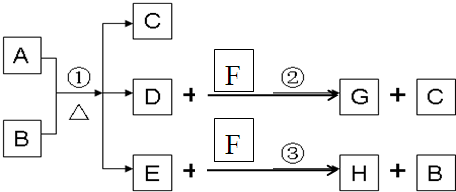
(1)写出下列物质的化学式
A
写出反应①的化学反应方程式
(2)G和过量NaOH溶液在加热时反应,氧化产物与还原产物的物质的量之比为1:2,写出该反应的离子方程式
(3)检验E中阴离子的操作方法为:

(1)写出下列物质的化学式
A
Cu
Cu
DSO2
SO2
FH2S
H2S
GS
S
HCuS
CuS
,写出反应①的化学反应方程式
Cu+2H2SO4(浓)
CuSO4+SO2+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2+2H2O
| ||
(2)G和过量NaOH溶液在加热时反应,氧化产物与还原产物的物质的量之比为1:2,写出该反应的离子方程式
3S+6OH-=2S2-+SO32-+3H2O
3S+6OH-=2S2-+SO32-+3H2O
(3)检验E中阴离子的操作方法为:
取少量E溶液,先加入稀盐酸,再加入BaCl2溶液,若产生白色沉淀,则证明有SO42-存在
取少量E溶液,先加入稀盐酸,再加入BaCl2溶液,若产生白色沉淀,则证明有SO42-存在
.分析:(1)G为淡黄色固体,应为S,说明除A、C外其余各物质均含同一种元素S,则F为H2S,D应为SO2,与H2S反应生成S和H2O,所以C为H2O,H为黑色沉淀,应为CuS,则A为Cu,B为H2SO4,浓硫酸与铜反应生成CuSO4、SO2和H2O,则E为CuSO4;
(2)根据反应物的物质的量关系结合物质的性质书写离子方程式;
(3)从SO42-离子的检验方法解答.
(2)根据反应物的物质的量关系结合物质的性质书写离子方程式;
(3)从SO42-离子的检验方法解答.
解答:解:(1)G为淡黄色固体,应为S,说明除A、C外其余各物质均含同一种元素S,则F为H2S,D应为SO2,与H2S反应生成S和
H2O,所以C为H2O,H为黑色沉淀,应为CuS,则A为Cu,B为H2SO4,浓硫酸与铜反应生成CuSO4、SO2和H2O,则E为CuSO4,反应的化学方程式为Cu+2H2SO4(浓)
CuSO4+SO2+2H2O,
故答案为:Cu;SO2;H2S;S;CuS;Cu+2H2SO4(浓)
CuSO4+SO2+2H2O;
(2)S和过量NaOH溶液在加热时反应,氧化产物与还原产物的物质的量之比为1:2,
反应的离子方程式为3S+6OH-=2S2-+SO32-+3H2O,故答案为:3S+6OH-=2S2-+SO32-+3H2O;
(3)实验室检验SO42-的方法为取少量E溶液,先加入稀盐酸,再加入BaCl2溶液,若产生白色沉淀,则证明有SO42-存在,
故答案为:取少量E溶液,先加入稀盐酸,再加入BaCl2溶液,若产生白色沉淀,则证明有SO42-存在.
H2O,所以C为H2O,H为黑色沉淀,应为CuS,则A为Cu,B为H2SO4,浓硫酸与铜反应生成CuSO4、SO2和H2O,则E为CuSO4,反应的化学方程式为Cu+2H2SO4(浓)
| ||
故答案为:Cu;SO2;H2S;S;CuS;Cu+2H2SO4(浓)
| ||
(2)S和过量NaOH溶液在加热时反应,氧化产物与还原产物的物质的量之比为1:2,
反应的离子方程式为3S+6OH-=2S2-+SO32-+3H2O,故答案为:3S+6OH-=2S2-+SO32-+3H2O;
(3)实验室检验SO42-的方法为取少量E溶液,先加入稀盐酸,再加入BaCl2溶液,若产生白色沉淀,则证明有SO42-存在,
故答案为:取少量E溶液,先加入稀盐酸,再加入BaCl2溶液,若产生白色沉淀,则证明有SO42-存在.
点评:本题考查无机物的推断,题目难度中等,本题注意推断的几个关键点①G为淡黄色固体②H为黑色沉淀③除A、C外其余各物质均含同一种元素X.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目




