题目内容
一定量的盐酸跟过量锌粉反应时,为了减缓反应速率但又不影响生成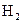 的总量,可采取的措施是( )
的总量,可采取的措施是( )
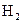 的总量,可采取的措施是( )
的总量,可采取的措施是( )A.加入少量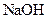 固体 固体 | B.加入少量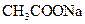 固体 固体 |
C.加入少量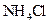 固体 固体 | D.加入少量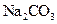 固体 固体 |
B
不影响生成氢气的量,则加入的物质不能与盐酸反应,A、D项不正确。加入少量
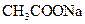 固体,由于CH3COO—的水解H+浓度减低,化学反应速率减慢,但不影响氢气的量,B正确。加入少量
固体,由于CH3COO—的水解H+浓度减低,化学反应速率减慢,但不影响氢气的量,B正确。加入少量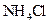 固体,NH4+水解H+浓度升高,反应速率增大,C项不正确。
固体,NH4+水解H+浓度升高,反应速率增大,C项不正确。
练习册系列答案
相关题目
 (3)你认为B、C、D元素形成的化合物之间_________(填“能”或“不能”)发生下面的反应BC+BD3 D BC2+D2C,得出上面结论的理由是________________。
(3)你认为B、C、D元素形成的化合物之间_________(填“能”或“不能”)发生下面的反应BC+BD3 D BC2+D2C,得出上面结论的理由是________________。 (4)Ⅰ.恒温恒压下,在一体积可变的密闭容器中发生下列反应:
(4)Ⅰ.恒温恒压下,在一体积可变的密闭容器中发生下列反应: E(g)当反应进行到4min时,测知M的浓度为0.2mol/L;反应进行到2min时,密闭容器中M的物质的量浓度为( )
E(g)当反应进行到4min时,测知M的浓度为0.2mol/L;反应进行到2min时,密闭容器中M的物质的量浓度为( )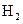 和
和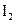 各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定
各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定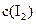 的变化,5S时测定
的变化,5S时测定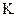 = ;
= ; 2SO3达到平衡后,再向反应容器中充入含氧的同位素
2SO3达到平衡后,再向反应容器中充入含氧的同位素 的氧气,经过一段时间后,
的氧气,经过一段时间后, C(g)3D(g);
C(g)3D(g);



 2Z(g);△H<0,在密闭容器中反应达到平衡时,X物质的量浓度为0.4mol/L。下列说法正确的是 ( )
2Z(g);△H<0,在密闭容器中反应达到平衡时,X物质的量浓度为0.4mol/L。下列说法正确的是 ( )