题目内容
5.常温下,下列叙述正确的是( )| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 在①中加入NH4Cl晶体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 分别在等体积的②、④两溶液加水稀释100倍,所得溶液中水电离出的c(H+)相等 | |
| C. | ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | ②、③两溶液混合,若所得溶液的pH=7,则c(CH3COO-)>c(Na+) |
分析 A、氨水中加入氯化铵,铵根离子浓度增大,抑制一水合氨的电离;
B、常温下,KW=10-14,NaOH与HCl都是强电解质,加水稀释100倍,pH变化2,NaOH溶液的pH=9,HCl的pH=5,据此分析;
C、氨水与盐酸混合所得溶液中只有4种离子,据电荷守恒分析;
D、常温下pH=7,说明c(OH-)=c(H+),据电荷守恒分析.
解答 解:A、氨水中加入氯化铵,铵根离子浓度增大,抑制一水合氨的电离,c(NH3•H2O)增大,c(OH-)减小,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小,故A错误;
B、NaOH溶液的pH=9,HCl的pH=5,则水电离出来的氢离子浓度与氢氧根离子浓度相等为10-9mol/L,故B正确;
C、①、④两溶液等体积混合,得到氯化铵和一水合氨的混合溶液,溶液中只有上述4种离子,若c(Cl-)>c(NH4+)>c(OH-)>c(H+),则阴离子总数大于阳离子,不符合电荷守恒,应为c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;
D、②、③两溶液混合,若所得溶液的pH=7,则c(CH3COO-)=c(Na+)>c(OH-)=c(H+),故D错误;
故选B.
点评 本题综合考查较为综合,涉及酸碱混合的定性判断、离子浓度大小比较,综合考查学生的分析能力,为高考常见题型和高频考点,注意把握弱电解质的电离特点,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列物质中氧原子数目与11.7gNa2O2中氧原子数一定相等的是( )
| A. | 6.72L CO | B. | 6.6g CO2 | C. | 8 g SO2 | D. | 9.6g H2SO4 |
10.下列装置或操作能达到目的是( )
| A. | 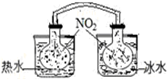 依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| B. | 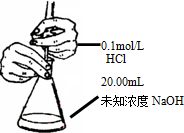 测定锥形瓶内的NaOH的浓度 | |
| C. | 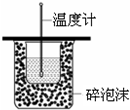 测定中和热 | |
| D. | 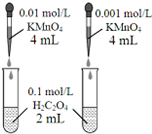 依据褪色快慢比较浓度对反应速率的影响 |
14.在含有硝酸铜、硝酸镁、硝酸银的溶液中加入适量锌粉,首先置换出的是( )
| A. | Mg | B. | Cu | C. | Ag | D. | H2 |
 .实验室制取并检验气体A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则是氨气.
.实验室制取并检验气体A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则是氨气. 已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国 家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国 家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示. =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O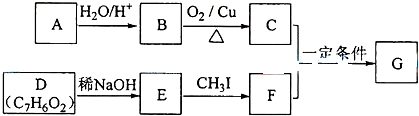
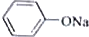 +RCH2I→
+RCH2I→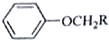
 .
.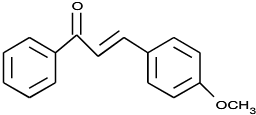 .
.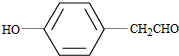 (写结构简式).
(写结构简式).