题目内容
7.实验室可用金属铁与氯气反应制备无水三氯化铁(FeCl3:棕黄色,易潮解,100℃升华).下面两套实验装置,左边反应装置相同,右边产品收集装置不同,分别如Ⅰ和Ⅱ所示.

(1)B中化学反应式4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(2)D中反应开始前,需排除装置中的空气,采取的方法B中的反应进行一段时间后,看到共绿色气体充满装置,再开始加热D
(3)D中化学反应式2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3
(4)装置Ⅰ主要缺点,除了尾气排入空气,污染环境外,还有导管易被产品堵塞
(5)装置Ⅱ主要缺点产品易潮解改进措施在瓶E和F之间连接装有干燥剂的装置.
分析 (1)实验室用氯气和铁反应制取氯化铁,所以首先要制取氯气,一般常用浓盐酸和二氧化锰反应制取氯气;
(2)利用生成的氯气排出装置中的空气来分析;
(3)加热条件下,氯气和铁反应生成氯化铁;
(4)导管易被产品堵塞,有毒气体应该有尾气处理装置;
(5)尾气处理装置中有水,导致氯化铁易潮解.
解答 解:(1)实验室用氯气和铁反应制取氯化铁,所以首先必须制取氯气,实验室常用浓盐酸和二氧化锰加热制取氯气,加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,所以B中发生的化学反应是4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)D中的反应开始前,需排除装置中的空气,防止氧气和铁反应生成铁的氧化物而产生杂质,所以D中的反应开始前,必须排除装置中的空气,其方法是B中的反应进行一段时间后,看到共绿色气体充满装置,再开始加热D,
故答案为:B中的反应进行一段时间后,看到共绿色气体充满装置,再开始加热D;
(3)加热条件下,铁和氯气反应生成氯化铁,反应方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,
故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(4)该装置Ⅰ主要缺点,除了尾气排入空气,污染环境外,导气管口较小,D装置中的固体物质易堵塞导管口,
故答案为:导管易被产品堵塞;
(5)该装置中有尾气处理装置,但尾气处理装置中是水溶液,会导致E中有水蒸气,会导致氯化铁产品易潮解,所以为防止氯化铁潮解,在瓶E和F之间连接装有干燥剂的装置,
故答案为:产品易潮解;在瓶E和F之间连接装有干燥剂的装置.
点评 本题考查了制备实验方案中的有关知识,题目难度中等,注意加热时,无论铁是否过量,铁和氯气反应都生成氯化铁不是氯化亚铁,为易错点.

| A. | 用石墨作电极电解AIC13溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H202+6H+═2Mn2++4O2↑+6H2O | |
| C. | 石灰水中加入过量小苏打溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 0.2 mol/L的NH4Al( SO4)2溶液与0.3 mol/L的Ba( OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| A. | 标准状况下,64gCu与足量浓硝酸反应恰好生成2NA个NO2分子 | |
| B. | 120gNaHSO4固体中含有NA个阳离子 | |
| C. | Si-O键的键能大于Si-Cl键的键能,因此SiO2的熔点高于晶体SiCl4的熔点 | |
| D. | CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等 |
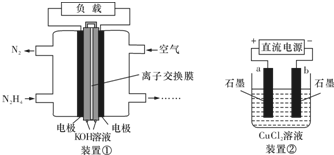
| A. | 该燃料电池负极发生的电极反应为:N2H4+4OH--4e-═N2↑+4H2O | |
| B. | 用该燃料电池作为装置②的直流电源,产生7.1g Cl2至少需加入0.5 mol N2H4 | |
| C. | 该燃料电池中,电子从左侧电极经外电路流向右侧电极,溶液OH-迁移到左侧 | |
| D. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
 ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )| A. | 先加酸性高锰酸钾溶液,后加银氨溶液,微热 | |
| B. | 先加溴水,后加酸性高锰酸钾溶液 | |
| C. | 先加银氨溶液,微热,再加入溴水 | |
| D. | 先加入新制氢氧化铜,微热.酸化后再加溴水 |