题目内容
下列各组热化学方程式中,化学反应的ΔH前者小于后者的是
①C(s)+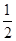 O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
②S(g)+O2(g) ===SO2(g);ΔH3 S(s)+O2(g) ===SO2(g);ΔH4
③CaO(s)+H2O(l) ===Ca(OH)2(s);ΔH5 CaCO3(s) ===CaO(s)+CO2(g);ΔH6
| A.② | B.①② | C.①③ | D.②③ |
D
解析试题分析:碳完全燃烧放出的热量多,但放热反应中△H<0,因此放热越多△H越小,即ΔH前者大于后者,①不正确;由于气态硫的总能量高于固态硫的总能量,因此气态硫燃烧放出的热量多,则ΔH前者小于后者,②正确;生石灰溶于水是放热反应,碳酸钙分解是吸热反应,△H>0,则ΔH前者小于后者,③正确,答案选D。
考点:考查反应热的大小比较

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
根据碘与氢气反应的热化学方程式
(1)I2(g)+ H2(g) 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
(2)I2(s)+ H2(g) 2HI(g) ΔH=+26.48 kJ/mol
2HI(g) ΔH=+26.48 kJ/mol
下列判断正确的是
| A.254 g I2(g)中通入2 gH2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(2)的反应物总能量比反应(1)的反应物总能量低 |
| D.反应(1)的产物比反应(2)的产物稳定 |
下列说法中,正确的是
| A.CO燃烧是放热反应 |
| B.升高温度,可以改变化学反应的反应热 |
| C.1 mol CH3COOH与1 mol NaOH完全中和,所放出的热量为中和热 |
| D.1 mol H2在足量Cl2中完全燃烧所放出的热量,是H2的燃烧热 |
下列反应中的能量变化关系符合下图所示的是
| A.盐酸与烧碱反应 | B.天然气燃烧 |
| C.三氧化硫与水反应 | D.煅烧石灰石 |
已知在1×105Pa,298K条件下,1mol氢气燃烧生成水蒸气放出242kJ热量,下列热化学方程式正确的是
| A.H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1 |
| B.H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1 |
| C.2H2(g)+O2(g)=2H2O(l)ΔH=-484kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(g)ΔH=+484kJ·mol-1 |
分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是
| “嫦娥一号” 发射火箭燃料 | 液氢(H2) | ①2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1 ②2H2(l)+O2(l)=2H2O(g) △H=-482.6kJ·mol-1 |
| 北京奥运会“祥云” 火炬燃料 | 丙烷(C3H8) | ③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=-2013.8kJ·mol-1 ④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ·mol-1 |
C.285.8 kJ·mol-1,2013.8 kJ·mol-1 D.285.8 kJ·mol-1,2221.5 kJ·mol-1
下列化学用语的相关表述正确的有 ( )
| A.H+(aq)+OH-(aq)=H2O(l) ΔH=" -a" kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为a kJ |
| B.因CuSO4·5H2O(s)=CuSO4(s)+5H2O(l) ΔH="+b" kJ/mol,故1 mol CuSO4(s)溶于水时,放出热量b kJ |
| C.因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(l)=2H2(g)+O2(g) ΔH="+c" kJ/mol |
D.因N2(g)+3H2(g)  2NH3(g) ΔH=" -" d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ 2NH3(g) ΔH=" -" d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ |
下列说法中,正确的是( )
| A.化学反应除了生成新物质外,还伴随着能量的变化 |
| B.放热反应不需要加热就可以发生 |
| C.反应条件为加热的反应都是吸热反应 |
| D.化学反应放热还是吸热,取决于反应条件 |
下列说法或表示方法正确的是 ( )。
| A.反应物的总能量低于生成物的总能量时,反应一定不能自发进行 |
| B.已知:H2S(g)+aO2(g)=x+bH2O(l) ΔH,若ΔH表示H2S的燃烧热,则x为SO2(g) |
| C.已知:2SO2(g)+O2(g)??2SO3(g) ΔH=-98.3 kJ·mol-1,在密闭容器中充入1 mol SO2和0.5 mol O2,充分反应后放出49.15 kJ的热量 |
| D.由石墨比金刚石稳定可得:C(s,金刚石)=C(s,石墨) ΔH>0 |