题目内容
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成.某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si.

有关氢氧化物沉淀的pH见下表:
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
(1)滤液A中含有的阳离子有______.
(2)操作②中涉及的化学方程式为______,
操作④中生成沉淀G的离子方程式为______.
(3)操作⑤中调节pH到5~6时,可以用到的试剂(填序号)______.
a.NaOH溶液 b.氨水 c.MgO d.Mg(OH)2
(4)从滤液H制取金属Mg的流程如下:

流程中由MgCl2冶炼Mg的方法是______.在干燥的HCl气流中加热MgCl2?6H2O制取无水氯化镁的原因是______.
故答案为:Fe3+、Al3+、Mg2+、H+;
(2)由(1)分析可知操作②中不溶物为SiO2,工业上粗硅的生产,用二氧化硅和碳反应,碳是还原剂,二氧化硅是氧化剂,碳元素化合价由0价变为+2价,硅元素化合价由+4价变为0价,反应方程式为2C+SiO2
 Si+2CO↑;滤液A中含有镁离子、铁离子和铝离子、氢离子,氢离子和氢氧化钠反应生成水,镁离子、铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化镁、氢氧化铁不溶于氢氧化钠溶液中,但氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,偏铝酸根离子和二氧化碳反应生成氢氧化铝和碳酸氢根离子,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
Si+2CO↑;滤液A中含有镁离子、铁离子和铝离子、氢离子,氢离子和氢氧化钠反应生成水,镁离子、铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化镁、氢氧化铁不溶于氢氧化钠溶液中,但氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,偏铝酸根离子和二氧化碳反应生成氢氧化铝和碳酸氢根离子,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;故答案为:2C+SiO2
 Si+2CO↑;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
Si+2CO↑;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;(3)操作⑤中加入的物质能和盐酸反应,且不引进新的杂质,氧化镁、氢氧化镁难溶于水,但能与酸反应,可起调节pH作用,故答案为:cd;
(4)镁是活泼金属,应采用电解其熔融盐的方法冶炼,所以工业上用电解熔融氯化镁的方法冶炼镁,反应方程式为:MgCl2
 Mg+Cl2↑,镁离子易水解生成氢氧化镁和氢离子,在氯化氢气流中加热该固体时,氢离子浓度增大,抑制镁离子水解生成氢氧化镁,并带走水分,
Mg+Cl2↑,镁离子易水解生成氢氧化镁和氢离子,在氯化氢气流中加热该固体时,氢离子浓度增大,抑制镁离子水解生成氢氧化镁,并带走水分,故答案为:电解;防止Mg2+水解,并带走水分.
分析:(1)蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成,蛇纹石加过量盐酸溶解后,MgO、Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解;
(2)不溶物为SiO2,二氧化硅和碳反应变成硅,碳元素化合价由0价变为+2价,硅元素化合价由+4价变为0价,碳是还原剂,二氧化硅是氧化剂;滤液A中含有镁离子、铁离子和铝离子、氢离子,氢离子和氢氧化钠反应生成水,镁离子、铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化镁、氢氧化铁不溶于氢氧化钠溶液中,但氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,偏铝酸根离子和二氧化碳能发生反应;
(3)加入的物质能和酸反应且不能引进杂质;
(4)活泼金属采用电解的方法冶炼;镁离子易水解生成氢氧化镁和氢离子,在氯化氢气流中加热该固体可以抑制其水解.
点评:本题主要考查了元素化合物中金属铝、铁的性质,解题时不仅需熟知物质间的反应原理,还需灵活运用于实验的设计,题目难度中等.

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下:
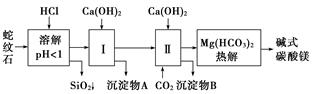
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是__________________。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)。
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解、________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_____________________ ___________________________________________________(填入物质的化学式),
然后______________________________________________________________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是________(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量
②高温分解
③________________________________________________________________________
④________________________________________________________________________
⑤MgO称量
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:
a=________,b=________,c=________。




