题目内容
【题目】把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。下列叙述正确的是( )
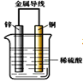
A. 该装置将化学能转变为电能
B. 电流从锌片流向铜片
C. 一段时间后,铜片质量减轻
D. 锌片发生还原反应
【答案】A
【解析】
该装置能自发的进行氧化还原反应Zn+2H+= Zn2++H2↑,能构成原电池,其中锌易失电子发生氧化反应,作负极,铜作正极,结合原电池原理分析解答。
A.该装置是原电池,是将化学能转化为电能的装置,故A正确;
B.该装置中,锌易失电子,作负极,铜作正极,电流从正极铜沿导线流向负极锌,故B错误;
C.铜作正极,正极上发生2H++2e-=H2↑,所以铜片质量不变,故C错误;
D.该装置中,锌片上发生Zn-2e-=Zn2+,属于氧化反应,故D错误;
故选A。

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目