��Ŀ����
����Ŀ����һ���̶�������ܱ��������� 2mol A �� 1mol B���������·�Ӧ��2A��g��+B��g�� 3C��g��+D��g����2 ���Ӻ�Ӧ�ﵽƽ�⣬C ��Ũ��Ϊ 1.2mol/L��
��1���� A ��ʾ 2 ������ƽ����Ӧ����Ϊ_____��A �ڵ� 1 ����ƽ������_______�� 2����ƽ�����ʣ���������������������=������
��2�������¶����ߣ�ƽ��ʱ��������ƽ����Է���������С��������ӦΪ_____��������������������������Ӧ��
��3������ B ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��_____���������գ�
�ټ��� A �ڼ��� B �ۼ�ѹ���ټ��� 1.6mol A+0.8mol B �ݽ� C ���������
��4��������ͬ�����£������������г��� 1.5mol C �� 0.5mol D ����������Ӧ��Ϊʹƽ���C ��Ũ����Ϊ 1.2mol/L����Ӧ�ٳ���_____molA ��_____molB��
��5������һ����ɱ�������У��÷�Ӧ�ﵽƽ��ʱ�����������ı������Ӧ���ʺͻ�ѧƽ��ı仯�������ͼ��a ��ı������������_____��b ��ı������������_____���������¶�ʱ���뽫��Ӧ���ʱ仯������� c-d ����_____________

���𰸡�0.4mol/(Lmin) > ���� �٢� 1 0.5 ����ѹǿ ����C��D 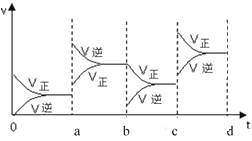
��������
��1��C��Ũ�ȱ仯ֵΪ1.2mol/L����֪C������Ϊ0.6 mol/(Lmin)��v(A)��v(C)=2��3������v(A)=0.4mol/(Lmin)���淴Ӧ����A��Ũ����С������A �ڵ� 1 ����ƽ�����ʴ��ڵ� 2����ƽ�����ʣ�
��2�������¶����ߣ�ƽ��ʱ��������ƽ����Է���������С��˵��ƽ���������������ķ����ƶ����������ƶ�����������Ϊ���ȷ�Ӧ��
��3���٢ݿ���ʹƽ�������ƶ������� B ��ת���ʣ��ڼ���B��Ȼ�ٽ�����Ӧ������B ��ת���ʼ�С���ۼ�ѹ������ƽ�������ƶ���B ��ת���ʼ�С�����ټ��� 1.6mol A��0.8mol B��A��B�ı�����ԭʼ������ͬ����Ϊ2��1�����Ըøı��൱�ڼ�ѹ��ʹƽ�������ƶ���B ��ת���ʼ�С������������Ǣ٢ݣ�
��4������Ϊ���Ե�Чƽ�⣬��Ҫ���ʼA��B��Ũ����ȣ�������һ�ߵ������ɵó��� 1.5mol C �� 0.5mol D��Ч�ڳ��� 1mol A �� 0.5mol B��Ҫ�ﵽC ��Ũ����Ϊ 1.2mol/L��Ҫ���ٳ��� 1mol A �� 0.5mol B��
��5��a�㴦ƽ�������ƶ�������������ǰ��ͼ��Ͽ�����������Ϊ����ѹǿ��b�㴦ƽ�������ƶ������ʼ�С����ǰ��ͼ�����ӣ����������Ƿ����C��D�������¶ȣ����淴Ӧ���ʶ�����ƽ�������ƶ�����ͼ��Ϊ�� ��
��

����Ŀ��ijʵ���ҷ�Һ��![]() ��Na+��Fe3+��Cr3+��
��Na+��Fe3+��Cr3+��![]() ��
��![]() �����ӣ���ͨ���������̱��Ϊ���Ʊ�K2Cr2O7��
�����ӣ���ͨ���������̱��Ϊ���Ʊ�K2Cr2O7��

��֪��
(a)![]() ��
��![]()
(b)����������������������pH�������
�������� | pH | |
��ʼ���� | ��ȫ���� | |
Fe3+ | 2.7 | 3.7 |
Cr3+ | 4.9 | 6.8 |
��ش�
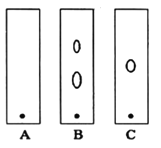
(1)ijͬѧ����ֽ�������жϲ���ټ���KOH�����Ƿ���ʡ��ڼ���һ����KOH��Һ����ëϸ��ȡ��������������ɫ��չ������Ѭ��İߵ���ͼ��ʾ������KOH���ʺϵ�ʵ������(ʵ��˳���Ѵ���)________��C�İߵ���ɫΪ________��
(2)����ں�Cr���ʷ�������Ҫ��Ӧ�����ӷ���ʽΪ________________________��
(3)������װ���У���Ӧѡ��________��(����)
(4)�������ʵ��ܽ��������ͼ2������ݿ����õ����в��ֲ�����a�����������ִ������壬ֹͣ���ȣ�b����ȴ�����£�c����������Һ���־�Ĥ��ֹͣ���ȣ�d��ϴ�ӣ�e�����ȹ��ˣ�f�����ˡ���ѡ����ʲ�������ȷ˳��________��
(5)������к��ʵ�ϴ�Ӽ���________(����ˮ�Ҵ��������Ҵ�-ˮ���Һ��������ˮ��������ˮ��)��
(6)ȡmg�ֲ�Ʒ���250mL��Һ��ȡ25.00mL����ƿ�У���cmol��L-1��(NH4)2Fe(SO4)2����Һ�ζ�(���ʲ���Ӧ)�����ı�(NH4)2Fe(SO4)2��ҺVmL����ôֲ�Ʒ��K2Cr2O7�Ĵ���Ϊ________��
����Ŀ������7ƿʧȥ��ǩ���Լ�ƿ����֪����ʢװ��Һ��������Ҵ������ᡢ����������������֬����������Һ��������Һ����ͨ������ʵ����ȷ�����Լ�����װҺ������ơ�
ʵ�鲽��ͷ��� | ʵ������ |
�ٰ�7ƿҺ�����α��ΪA��B��C��D��E��F��G������ζ | ֻ��F��G����Һ��û����ζ |
�ڸ�ȡ�������Թ��м�ˮϡ�� | ֻ��C��D��E����Һ�岻�ܽ������ˮ�ϲ� |
�۷ֱ�ȡ����7��Һ�����Թ��м����Ƶ� | ֻ��Bʹ�����ܽ⣬F�в���ש��ɫ���� |
�ܸ�ȡC��D��E�������Թ��У���ϡ | ֻ��C�����зֲ���������D���Թ����ŵ�������ζ |
��1����д��������Ŵ�����Һ�����ƣ�
A________��B________��C_______��D_______��E______��F______��G________��
��2��д����D�м���![]() ��Һ�����ȵĻ�ѧ����ʽ��_______��
��Һ�����ȵĻ�ѧ����ʽ��_______��
����Ŀ��50mL 1.0molL-1 ����� 50mL 1.1molL-1 ����������Һ��ͼ 1 װ���н����кͷ�Ӧ����ͨ���ⶨ��Ӧ���������ų��������������к��ȡ��Իش��������⣺

��1��д���÷�Ӧ���к����Ȼ�ѧ����ʽ��___________��
��2��___________���������������������������β����������Ϊ����ͭ������ԭ����_____��
��3��������� 60mL 1.0molL-1 ����� 50mL 1.1molL-1 ����������Һ���з�Ӧ����������ʵ����ȣ���������_____���������������������������������������к�����ֵ_____����������������������������������
��4��ij�о�С�齫װ�����ƺ� V1 mL 1.0mol/L HCl ��Һ�� V2 mL δ֪Ũ�ȵ� NaOH ��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ 2 ��ʾ��ʵ����ʼ�ձ��� V1+V2 = 50mL�����ش��������⣺�о�С������ʵ��ʱ�����¶�_________����������������������������������22�档
��5��������д�±��еĿհף�
�¶� ʵ����� | ��ʼ�¶� t1�� | ��ֹ�¶� t2/�� | �¶Ȳ�ƽ��ֵ (t2��t1)/�� | ||
HCl | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 32.9 | ________________________ |
2 | 27.0 | 27.4 | 27.2 | 37.0 | |
3 | 25.9 | 25.9 | 25.9 | 32.5 | |
4 | 26.4 | 26.2 | 26.3 | 33.3 | |
�ڽ�����Ϊ 50mL 1.0molL-1 ����� 50mL 1.1molL-1 ����������Һ���ܶȶ��� 1 g/cm3���кͺ�������Һ�ı����� c��4.18 J/(g����)�����к����� H��_________( ȡС�����һλ)��
����Ŀ��1,![]() ���ȱ���
���ȱ���![]() ��һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ��ñ�ϩ�ӳɷ��Ʊ�����Ҫ������Ϊ
��һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ��ñ�ϩ�ӳɷ��Ʊ�����Ҫ������Ϊ![]() �ȱ�ϩ
�ȱ�ϩ![]() ����Ӧԭ��Ϊ��
����Ӧԭ��Ϊ��
��![]()
![]() CH2ClCHClCH3(g) H1= -134KJ/mol-1
CH2ClCHClCH3(g) H1= -134KJ/mol-1
��![]()
![]() CH2=CHCH2Cl(g)+HCl(g) H2= -102KJ/mol-1
CH2=CHCH2Cl(g)+HCl(g) H2= -102KJ/mol-1
��ش��������⣺
![]() ��֪
��֪![]()
![]()
![]() �Ļ��
�Ļ��![]() ��
��![]() Ϊ132KJ/mol-1����÷�Ӧ�Ļ��
Ϊ132KJ/mol-1����÷�Ӧ�Ļ��![]() ��
��![]() Ϊ__________ KJ/mol-1��
Ϊ__________ KJ/mol-1��
![]() һ���¶��£�������ܱ������г�������ʵ�����
һ���¶��£�������ܱ������г�������ʵ�����![]() ��
��![]() ���ڴ��������·�����Ӧ�������������ѹǿ��ʱ��ı仯���±���ʾ��
���ڴ��������·�����Ӧ�������������ѹǿ��ʱ��ı仯���±���ʾ��
ʱ�� | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
ѹǿ | 80 |
|
|
|
|
|
|
�����õ�λʱ���������ѹ�ı仯����ʾ��Ӧ���ʣ�����=![]() ����ǰ
����ǰ![]() ��ƽ����Ӧ������(CH2ClCHClCH3)=__________kPamin-1(����С�����2λ
��ƽ����Ӧ������(CH2ClCHClCH3)=__________kPamin-1(����С�����2λ![]() ��
��
�ڸ��¶��£���ƽ��ʱHCl���������Ϊ![]() �����ϩ��ƽ����ת������=__________����Ӧ���ƽ�ⳣ��
�����ϩ��ƽ����ת������=__________����Ӧ���ƽ�ⳣ��![]() ________
________![]() Ϊ�Է�ѹ��ʾ��ƽ�ⳣ��������С�����2λ
Ϊ�Է�ѹ��ʾ��ƽ�ⳣ��������С�����2λ![]() ��
��
![]() ij�о�С�����ܱ������г���һ������
ij�о�С�����ܱ������г���һ������![]() ��
��![]() ���ֱ���A��B���ֲ�ͬ���������·�����Ӧ��һ��ʱ�����
���ֱ���A��B���ֲ�ͬ���������·�����Ӧ��һ��ʱ�����![]() �IJ������¶ȵĹ�ϵ��ͼ��ʾ��
�IJ������¶ȵĹ�ϵ��ͼ��ʾ��

����˵���������____________![]() �����
�����![]() ��
��
![]() ʹ�ô���A������¶�ԼΪ250��
ʹ�ô���A������¶�ԼΪ250��
![]() ��ͬ�����£��ı�ѹǿ��Ӱ��
��ͬ�����£��ı�ѹǿ��Ӱ��![]() �IJ���
�IJ���
c.![]() ���Ƕ�Ӧ�¶���
���Ƕ�Ӧ�¶���![]() ��ƽ�����
��ƽ�����
![]() ���
���![]() ��Ӧѡ���ԵĹؼ������ǿ����¶�
��Ӧѡ���ԵĹؼ������ǿ����¶�
(4)���ĸ������ܱ������г�����Ӧ��������(��ͼ)��

������Ӧ2N2O(g)![]() 2N2(g)+O2(g) ��H����������N2O��ƽ��ת������ͼ��ʾ��
2N2(g)+O2(g) ��H����������N2O��ƽ��ת������ͼ��ʾ��

����II���������Ϊ1L���������е�����Ҳ��470���½��з�Ӧ����ʼ��Ӧ���ʣ�
��![]() ��(N2O)____��(N2O)��(�������������=��)
��(N2O)____��(N2O)��(�������������=��)
��ͼ��A��B��C���㴦�������ܶ����ĵ���____(�A����B����C��)��
