题目内容
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
| A、HCN易溶于水 |
| B、HCN溶液能导电 |
| C、1mol/L氢氰酸溶液的pH约为3 |
| D、10 mL1 mol?L-1HCN恰好与10 mL 1 mol?L-1 NaOH溶液完全反应 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:氢氰酸为弱电解质,则利用其电离不完全来分析,一般测定溶液的pH或测定相同条件下与强酸的导电性比较以及对应盐溶液的酸碱性来判断.
解答:
解:A.不能利用物质的溶解性来判断是否为弱电解质,即溶解性与电解质的强弱无关,故A错误;
B.HCN溶液能导电,只能说明HCN在溶液中发生电离,但不能证明电离程度,故B错误;
C.1mol/L氢氰酸溶液的pH约为3,说明没有完全电离,可说明为弱酸,故C正确;
D.二者物质的量相等,不能证明酸性的强弱,故D错误.
故选C.
B.HCN溶液能导电,只能说明HCN在溶液中发生电离,但不能证明电离程度,故B错误;
C.1mol/L氢氰酸溶液的pH约为3,说明没有完全电离,可说明为弱酸,故C正确;
D.二者物质的量相等,不能证明酸性的强弱,故D错误.
故选C.
点评:本题考查弱电解质的判断方法,明确弱电解质在水中电离不完全是解答本题的关键,学生应注意在平时的学习中归纳判断弱电解质的方法,难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
下列离子方程式中,正确的是( )
A、水玻璃中通入足量的CO2:Si
| ||
| B、氯化亚铁溶液中通入足量的Cl2:2Fe2++Cl2═2Fe3++2Cl- | ||
| C、NaHCO3溶液中加入足量NaHSO4溶液:2H++CO32-═CO2↑+H2O | ||
| D、NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- |
下列有关操作及实验结论正确的是( )
| A、某溶液做焰色反应,现象为黄色,说明该溶液中不存在K+ |
| B、配制950mL1mol/LNa2CO3溶液时,应用托盘天平称取100.7g无水Na2CO3 |
| C、为证明酸性H2CO3>H2SiO3,可将CO2气体通入Na2SiO3溶液中观察现象 |
| D、用酒精萃取碘水中的I2 |
已知N≡N键的键能是a kJ?mol-1,H-H键的键能是b kJ?mol-1,N-H键的键能是c kJ?mol-1,则N2(g)+3H2(g)?2NH3(g)的△H(kJ?mol-1)为( )
| A、3c-a-b |
| B、a+b-3c |
| C、a+3b-2c |
| D、a+3b-6c |
下列说法中错误的是( )
| A、四氯甲烷为正四面体结构 |
| B、乙烯的所有原子在同一平面 |
| C、2-丁烯不止表示一种物质 |
| D、1-丁烯存在顺反异构现象 |
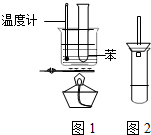 某学生为验证苯的沸点(80.1℃)比水低,设计了如图1所示的实验装置:(某些固定装置已略去)
某学生为验证苯的沸点(80.1℃)比水低,设计了如图1所示的实验装置:(某些固定装置已略去) 铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题:
铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题: