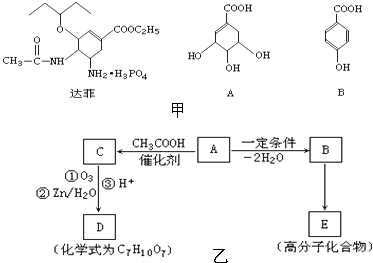
题目内容
【题目】用中和滴定法测定某盐酸的物质的量浓度.
(1)标准溶液应盛于(填“A”或“B”)滴定管中. 
(2)若选用酚酞作指示剂,以0.125 0molL﹣1的标准氢氧化钠溶液滴定,如何判断滴定终点
(3)实验数据记录如表,请分析数据并计算,盐酸的物质的量浓度=molL﹣1
滴定次数 | 待测液体体积/mL | 标准碱液 | |
滴定前读数/mL | 滴定后读数/mL | ||
① | 20.0 | 0.40 | 20.41 |
② | 20.0 | 0.10 | 20.60 |
③ | 20.0 | 4.00 | 23.99 |
【答案】
(1)A
(2)当加入最后一滴标准液时,溶液恰好出现红色且半分钟内红色不褪去
(3)0.1250
【解析】解:(1)用中和滴定法测定某盐酸的物质的量浓度,说明标准液为碱溶液,应该选用碱式滴定管,A为碱式滴定管,所以选用A,所以答案是:A;(2)盐酸中加入酚酞,溶液显示无色,盐酸反应完全后,加入氢氧化钠溶液后,溶液显示红色,所以滴定终点为:滴入最后一滴氢氧化钠溶液,锥形瓶中溶液恰好出现红色且半分钟内红色不褪去,
所以答案是:当加入最后一滴标准液时,溶液恰好出现红色且半分钟内红色不褪去;(3)第一次滴定消耗标准液的体积为:20.41mL﹣0.40mL=20.01mL;
第二次滴定消耗标准液体积为:20.60mL﹣0.10mL=20.50mL,
第三次滴定消耗标准液体积为:23.99mL﹣4.00mL=19.99mL,
第二次实验无效,两次消耗的标准液的平均体积为: ![]() mL=20.00mL,
mL=20.00mL,
待测液的体积20mL,根据反应关系式:NaOH~HCl,所以c待= ![]() =
= ![]() =0.1250molL﹣1 ,
=0.1250molL﹣1 ,
所以答案是:0.1250.
【考点精析】解答此题的关键在于理解酸碱中和滴定的相关知识,掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.

 互动英语系列答案
互动英语系列答案