题目内容
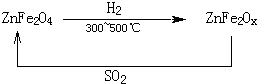
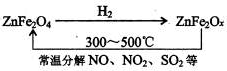
新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni,其均显+2价,下同),由铁酸盐MFe2O4经高温还原得到,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如下:

(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4 与H2的物质的量之比为2∶1,则还原产物MFe2Ox中x=________,MFe2Ox中+2价铁与+3价铁的物质的量之比为________。
(2)在酸性溶液中,Fe2O![]() 易转化为Fe2+:
易转化为Fe2+:
Fe2O![]() +2e-+8H+===2Fe2++4H2O
+2e-+8H+===2Fe2++4H2O
有K2MnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式并配平:__________________________。
解析:(1)MFe2O4被还原时,MFe2O4与H2的物质的量之比为2∶1,根据得失电子守恒,则(3-![]() )×2×2=2,x=3.5,即Fe在MFe2Ox的平均价态为+2.5价,则Fe2+和Fe3+物质的量之比为1∶1。
)×2×2=2,x=3.5,即Fe在MFe2Ox的平均价态为+2.5价,则Fe2+和Fe3+物质的量之比为1∶1。
(2)要使Fe2O![]() 被还原,应选择具有还原性的物质,只能是Cu2O,反应的方程式为:
被还原,应选择具有还原性的物质,只能是Cu2O,反应的方程式为:
Fe2O![]() +Cu2O+10H+===2Fe2++2Cu2++5H2O。
+Cu2O+10H+===2Fe2++2Cu2++5H2O。
答案:(1)3.5 1∶1
(2)Fe2O![]() +Cu2O+10H+===2Fe2++2Cu2++5H2O
+Cu2O+10H+===2Fe2++2Cu2++5H2O

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2009?抚顺模拟)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
(2009?抚顺模拟)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
 氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:
氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题: