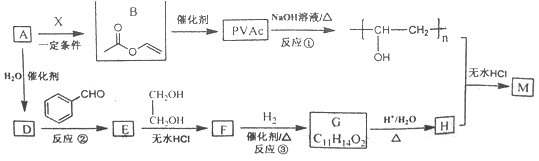
题目内容
【题目】钒(23V)被称为“现代工业味精”,可添加在钢铁中,并以钛一铝-钒合金的形式用于航天领域;钒的化合物被广泛用作催化剂、燃料及电池等。我国钒钛磁铁矿储量较大,是世界上产钒大国。请完成下列问题:
(1)钒的基态原子的价电子排布图为___________。
(2)钒的某种氧化物的晶胞结构如下图1所示,则该氧化物的化学式为___________,其熔沸点比下图3(为邻苯二甲酸酐的结构)物质的熔沸点要___________(填“高”“低”或“差不多”)。
(3)V2O5是一种常见的催化剂,在合成硫酸、硝酸、邻苯三甲酸酐、乙烯、丙烯中,均使用五氧化二钒作催化剂。

①五氧化二钒的结构简式如上图2所示,则该结构中含有___________个π键。
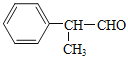
②在丙醛( CH3CH2CHO)分子中碳原子的杂化方式分别为___________。
③C、N、O、Ne四元素,其第一电离能从大到小的顺序依次为______________________。
④V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。列举与VO43-空间构型相同的一种阴离子:___________(填离子符号)。
(4)已知单质钒的晶体采用体心立方堆积,晶胞如上图4所示,假设钒原子直径为d×10-7cm,钒的相对原子质量为M,则晶体密度的表达式为___________g·cm-3。(设阿伏加德罗常数为NA)
【答案】![]() VO2 高 4 sp3、sp2 Ne>N>O>C SO42-(ClO4-、PO43-)
VO2 高 4 sp3、sp2 Ne>N>O>C SO42-(ClO4-、PO43-) ![]()
【解析】
(1)钒是23号元素,根据能量最低原理写出价电子排布图;
(2)根据均摊法计算晶胞中V、O原子数目,进而确定化学式,VO2是离子晶体,其熔点比分子晶体邻苯二甲酸酐的熔点要高;
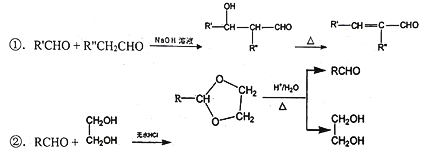
(3)①单键为![]() 键,双键含有一个1个
键,双键含有一个1个![]() 键和1个π键;
键和1个π键;
②甲基上的碳,形成4个![]() 键,为sp3,双键上的碳形成3个
键,为sp3,双键上的碳形成3个![]() 键,1个π键,为sp2杂化;
键,1个π键,为sp2杂化;
③N原子2p能级半充满状态和Ne原子2p能级全充满状态稳定,第一电离能大;
④V形成4个![]() 键,没有孤对电子的粒子,正四面体构型;
键,没有孤对电子的粒子,正四面体构型;
(4)均摊法确定钒原子数目表示出晶胞质量,根据晶胞边长与原子直径的关系用V原子直径表示出晶胞边长,再根据计算晶胞密度。
(1)钒是23号元素,钒的基态原子的价电子排布式为3d34s2,价电子排布图为![]() ;
;
故答案为:![]() ;
;
(2)由晶胞结构可知,含钒原子8×![]() +1=2,含氧原子4×
+1=2,含氧原子4×![]() +2=4,该氧化物的化学式为VO2,VO2是离子晶体,其熔点比分子晶体邻苯二甲酸酐的熔点要高;
+2=4,该氧化物的化学式为VO2,VO2是离子晶体,其熔点比分子晶体邻苯二甲酸酐的熔点要高;
故答案为:VO2;高;
(3)①由五氧化二钒的结构图可知,单键为![]() 键,双键含有一个1个
键,双键含有一个1个![]() 键和1个π键,可得出含有4个π键;
键和1个π键,可得出含有4个π键;
②在丙醛( CH3CH2CHO)分子中,甲基上的碳,形成4个![]() 键,为sp3,醛基碳氧双键上的碳形成3个
键,为sp3,醛基碳氧双键上的碳形成3个![]() 键,1个π键,为sp2杂化;
键,1个π键,为sp2杂化;
③N原子2p能级半充满状态和Ne原子2p能级全充满状态稳定,第一电离能大,所以C、N、O、Ne四元素,其第一电离能从大到小的顺序依次为Ne>N>O>C;
④V形成4个![]() 键,没有孤对电子的粒子,正四面体构型,与VO43-空间构型相同的一种阴离子:SO42-(ClO4-、PO43-);
键,没有孤对电子的粒子,正四面体构型,与VO43-空间构型相同的一种阴离子:SO42-(ClO4-、PO43-);
故答案为:4;sp3、sp2;Ne>N>O>C;SO42-(ClO4-、PO43-);
(4)晶胞中钒原子个数为8×![]() +1=2,钒原子直径为d×10-7cm,晶胞的体对角线长为2d×10-7cm,则晶胞的边长为
+1=2,钒原子直径为d×10-7cm,晶胞的体对角线长为2d×10-7cm,则晶胞的边长为![]() cm,钒的相对原子质量为M,则晶体密度
cm,钒的相对原子质量为M,则晶体密度![]() =
=![]() =
=![]() g·cm-3,
g·cm-3,
故答案为:![]() 。
。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】某实验小组用粗锌(杂质难溶于水且不与酸反应)与100g稀硫酸反应时,实验数据如下表所示:
实验序号 | 粗锌质量/g | 稀硫酸质量/g | 生成气体质量/g | 反应后剩余固体质量/g |
实验1 | 8 | 100 | 0.2 | 1.5 |
实验2 | 16 | 100 | 0.4 | 3 |
实验3 | 30 | 100 | 0.6 | 10.5 |
(1)实验中稀硫酸反应完的是______(填实验序号);
(2)计算稀硫酸的溶质质量分数______。