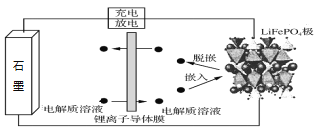
��Ŀ����
����Ŀ�����ݻ�������ܱ������д������·�Ӧ��2SO2(g)��O2(g)![]() 2SO3(g)������Ӧ���ȡ�ij�о�С���о���������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ���ǣ�
2SO3(g)������Ӧ���ȡ�ij�о�С���о���������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ���ǣ�

A. ͼI�о�����t0ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
B. ͼII�о�����t0ʱ�̼��������Է�Ӧ���ʵ�Ӱ��
C. ͼIII�о����Ǵ�����ƽ���Ӱ�죬�ҼĴ�Ч�ʱ��Ҹ�
D. ͼIII�о������¶ȶԻ�ѧƽ���Ӱ�죬�Ҽ��¶Ƚϸ�
���𰸡�B
��������
A������Ӧ���Ũ�ȣ����淴Ӧ���ʾ�������������Ӧ���������˲�䣬�淴Ӧ���ʲ��䣻
B������ֻ�ı䷴Ӧ���ʣ���Ӱ��ƽ���ƶ���
C��������Ӱ��ƽ���ƶ����������SO2 ��ת���ʲ��䣻
D�����ȹ���ƽ��ֵ�������ʱƽ���������ƶ�������
A������Ӧ���Ũ�ȣ����淴Ӧ���ʾ�������������Ӧ���������˲�䣬�淴Ӧ���ʲ��䣬�����淴Ӧ������t0ʱ�̲��䣬�����뿪ԭƽ��㣬��A����
B��������Ӱ��ƽ���ƶ������Լӿ췴Ӧ���ʣ���B��ȷ��
C��������Ӱ��ƽ���ƶ����������SO2 ��ת���ʲ��䣬��C������
D���ȹ���ƽ��ֵ��˵���ҵ��¶ȸ��ڼף�����ƽ�������ƶ���SO2��ת���ʽ��ͣ���D����

����Ŀ���о�����ȿ���CO��CO2��Ӧ�þ�����Ҫ��������塣�ش��������⣺
����CO�����ڸ�¯��������֪��
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) ��H1=a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ��H2=b kJ/mol
��ӦFe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)����H3=________kJ/mol���ú�a��b�Ĵ���ʽ��ʾ����
����һ�������£�CO2��CO���Ի���ת����
��1��ij�¶��£����ݻ�Ϊ2L���ܱ��������ס������ַ�ʽͶ�뷴Ӧ�����Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g)��
CO(g)+H2O(g)��
���� | ��Ӧ�� |
�� | 8 mol CO2(g)��16 mol H2(g) |
�� | w mol CO2(g)��x mol H2(g)��y mol CO(g)��z mol H2O(g) |
������15 min��ﵽƽ�⣬��ʱCO2��ת����Ϊ75%����0~15 min��ƽ����Ӧ����v(H2)=______���������¸÷�Ӧ��ƽ�ⳣ��K=______��
��ʹƽ������������ͬ�����������������ȣ���w��x��y��z������Ĺ�ϵ�ǣ�y______z�����������������=��������y=______���ú�x��w�ĵ�ʽ��ʾ����
��2���о��������¶ȡ�ѹǿ�Է�Ӧ��C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=H2(g)+CO(g) +H2O(g) ��H �����ұ���ƽ��ת����Ӱ����ͼ��ʾ��
C6H5CH=H2(g)+CO(g) +H2O(g) ��H �����ұ���ƽ��ת����Ӱ����ͼ��ʾ��

����H_____0�����������������=������ѹǿp1��p2��p3�Ӵ�С��˳����________��
��3��CO�ɱ�NO2������CO+NO2![]() CO2+NO�����¶ȸ���225��ʱ����Ӧ����v ��=k����c(CO)��c(NO2)��v��=k����c(CO2)��c(NO)��k����k���ֱ�Ϊ�����淴Ӧ���ʳ������������¶ȷ�Χ�ڣ�k����k����÷�Ӧ��ƽ�ⳣ��K֮��Ĺ�ϵΪ________��
CO2+NO�����¶ȸ���225��ʱ����Ӧ����v ��=k����c(CO)��c(NO2)��v��=k����c(CO2)��c(NO)��k����k���ֱ�Ϊ�����淴Ӧ���ʳ������������¶ȷ�Χ�ڣ�k����k����÷�Ӧ��ƽ�ⳣ��K֮��Ĺ�ϵΪ________��