题目内容
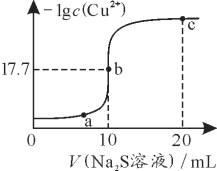
【题目】![]() 的两种一元酸HX和HY的溶液分别取50mL,加入过量的镁粉,充分反应后,收集
的两种一元酸HX和HY的溶液分别取50mL,加入过量的镁粉,充分反应后,收集![]() 的体积在相同状况下分别为
的体积在相同状况下分别为![]() 和
和![]() ,若
,若![]() ,下列说法正确的是
,下列说法正确的是![]()
A.HX可能是强酸
B.NaX水溶液的碱性弱于NaY水溶液的碱性
C.HX一定是弱酸
D.反应过程中二者生成H2的速率相同
【答案】C
【解析】
A.pH=2的两种一元酸HX与HY溶液,分别与足量Mg反应,HX产生氢气多,则HX为弱酸,故A错误;
B.因为酸性:![]() ,根据越弱越水解的原理,相同浓度的NaX,NaY溶液,NaX碱性强,故B错误;
,根据越弱越水解的原理,相同浓度的NaX,NaY溶液,NaX碱性强,故B错误;
C.![]() 的两种一元酸,分别取50mL加入足量镁粉,由
的两种一元酸,分别取50mL加入足量镁粉,由![]() ,说明HX溶液的浓度较大,则HX酸性较弱,HX一定是弱酸,故C正确;
,说明HX溶液的浓度较大,则HX酸性较弱,HX一定是弱酸,故C正确;
D.反应速率与氢离子浓度成正比,两种酸pH相等,所以开始时反应速率相等,因为HX为弱酸,随着反应的进行,电离平衡不断向电离方向移动,电离出氢离子,所以HX溶液中的氢离子浓度大于HY里的氢离子浓度,所以反应过程中HX反应速率快,故D错误;
答案:C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
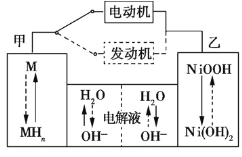
小学生10分钟应用题系列答案【题目】(1)镍氢碱性充电电池被誉为“绿色化学电源”,充、放电时的反应:![]() 。放电时,正极的电极反应式为 ______ ,充电时,该电极应与电源的 ______
。放电时,正极的电极反应式为 ______ ,充电时,该电极应与电源的 ______ ![]() 填“正”或“负”
填“正”或“负”![]() 极相连.
极相连.
(2)氨在氧气中燃烧,生成水和氮气。已知:![]() ;
;![]() ,
,![]() ;
;![]() ,则氨在氧气中燃烧生成液态水和氮气时的热化学方程式为: ______ 。
,则氨在氧气中燃烧生成液态水和氮气时的热化学方程式为: ______ 。
(3)研究表明工业上合成氨反应![]() 在
在![]() 、
、![]() 的平衡常数分别为
的平衡常数分别为![]() 和200。
和200。
①合成氨是 ______ 反应![]() 填“放热”或“吸热”
填“放热”或“吸热”![]() 。
。
②合成氨选择![]() 的原因是: ______ 。
的原因是: ______ 。
③在容积固定的密闭容器中发生上述反应,如表中为各物质在不同时刻的浓度:
时间 |
|
|
|
0 |
|
| 0 |
5 |
| X |
|
10 |
|
|
|
![]() ,
,![]() 的平均反应速率
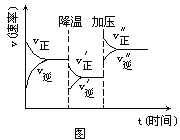
的平均反应速率![]() ______。反应在5分钟时,条件发生了改变,改变的条件可能是 ______
______。反应在5分钟时,条件发生了改变,改变的条件可能是 ______ ![]() 填序号
填序号![]() 。
。
![]() 使用催化剂
使用催化剂 ![]() 降低温度
降低温度 ![]() 增加氢气的浓度
增加氢气的浓度 ![]() 分离出
分离出![]()
(4)在![]() 时,液氨中存在电离平衡
时,液氨中存在电离平衡![]() ,离子积常数
,离子积常数![]() 。若一定条件下,平衡时
。若一定条件下,平衡时![]()
![]() ,下列说法正确的是 ______ 。
,下列说法正确的是 ______ 。
![]() ,液氨的离子积常数增大
,液氨的离子积常数增大
![]() 此温度下液氨的离子积常数为
此温度下液氨的离子积常数为![]()
![]() 液氨在
液氨在![]() 的电离程度比常温下纯水的大
的电离程度比常温下纯水的大
(5)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:![]() ,下列叙述正确的是 ______
,下列叙述正确的是 ______ ![]() 填字母
填字母![]() 。
。
A. 放电时负极反应为:![]()
B. 充电时阳极反应为:![]()
C. 放电时每转移3mol电子,正极有![]() 被氧化。
被氧化。